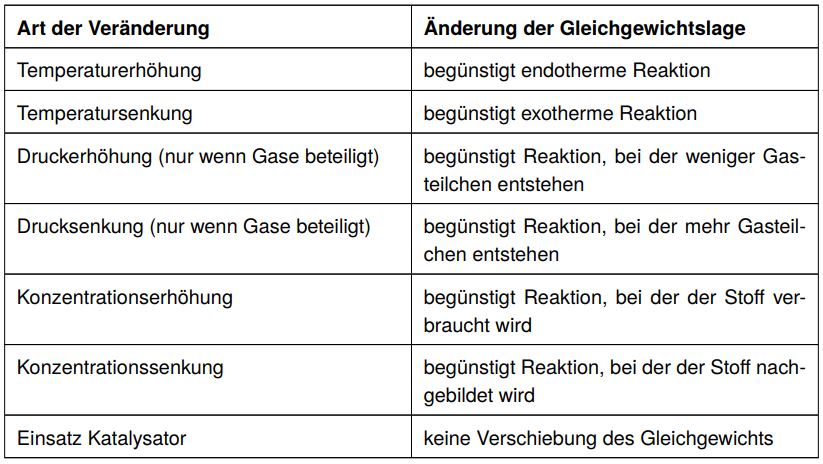
Beeinflussung der Gleichgewichtslage
Das chemische Gleichgewicht kann durch verschiedene Faktoren beeinflusst werden. Diese Beeinflussung der Gleichgewichtslage zeigen in diesem Artikel auf.
Wenn uns eine Reaktion vorliegt, bei der das Gleichgewicht stark auf der Seite der Edukte liegt, wir aber eigentlich die Produkte erzeugen wollen, benötigen wir enorm viele Edukte. Es gibt aber auch noch die Möglichkeit, auf das Gleichgewicht selbst einzuwirken.
Wenn auf eine chemische Reaktion, die sich im Gleichgewicht befindet, ein äußerer Zwang ausgeübt wird, weicht das Gleichgewicht diesem Zwang aus.
Dieses Prinzip nennt man das Gesetz vom kleinsten Zwang oder Prinzip von Le Chatelier.
Jetzt stellt sich die Frage, was ein solcher Zwang ist. Das können ganz verschiedene Einflüsse sein. Wir können ein chemisches Gleichgewicht durch Änderung folgender Größen verschieben:
- Druck
- Temperatur
- Konzetrnation
Um zu verstehen, wie und warum das Gleichgewicht durch eine Änderung verschoben wird, betrachten wir die Einflussgrößen im Folgenden genauer.
Temperatur
Bei einer chemischen Reaktion kennen wir bereits die Begriffe endotherm und exotherm.
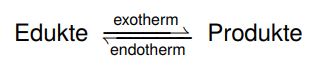
Wenn die Temperatur erhöht wird, verschiebt sich das Gleichgewicht der Reaktion hin zur endothermen Reaktion (hier nach links), da eine Temperaturerhöhung bedeutet, dass jetzt mehr Energie zur Verfügung steht, welche „aufgebraucht werden muss“. Um diese Energie aufzubrauchen, läuft die endotherme Reaktion verstärkt ab.
![]()
Wird die Temperatur gesenkt, verschiebt sich im Gegenzug das Gleichgewicht zur exothermen Reaktion (hier nach rechts). Wird die Temperatur gesenkt, heißt das, dass weniger Energie hinzugeführt wird. Das System möchte das ausgleichen, indem mehr Energie erzeugt wird. Also läuft die exotherme Reaktion verstärkt ab.
![]()
Druck
Eine Druckänderung wirkt sich nur auf das Gleichgewicht einer Reaktion aus, wenn Gase an der Reaktion beteiligt sind. Bei Stoffen in gasförmigem Zustand entfernen sich die Teilchen so weit voneinander wie möglich. Je mehr Teilchen vorhanden sind, umso mehr Platz benötigen diese entsprechend. Wenn sich der Platz jetzt verringert (Druckerhöhung), wird das Gleichgewicht auf die Seite verschoben, auf der weniger Gasteilchen vorliegen.
Das können wir mit Menschen in einem sehr kleinen Raum vergleichen. Es ist beispielsweise kein Problem, wenn zwei Personen in diesem kleinen Raum sind. Versuchen wir jetzt aber sieben Personen in demselben Raum unterzubringen, wird das durchaus unangenehm und jeder würde gerne flüchten. Genauso verhält es sich bei den Gasteilchen auch und die Reaktion läuft in die Richtung ab, bei
der weniger Teilchen sich den kleinen Raum teilen müssen.
Wird jetzt der Druck allerdings gesenkt, steht mehr Platz für die Teilchen zur Verfügung. In diesem Fall wird das Gleichgewicht in die Richtung verschoben, auf der mehr Gasteilchen vorhanden sind. Machen wir auch hier wieder den Vergleich mit mehreren Menschen in einem Raum: Wir stellen uns vor, dass wir alleine in einem riesigen Saal stehen. Da wir uns hier aber einsam fühlen, holen wir all unsere Freunde dazu.
Wir betrachten das Ganze jetzt noch an einer Beispielreaktion: Stickstoff und Wasserstoff reagieren zu Ammoniak.
![]()
Auf der linken Seite haben wir ein Stickstoff-Molekül und drei WasserstoffMoleküle, auf der rechten Seite stehen zwei Ammoniak-Moleküle. Alle an dieser Reaktion beteiligten Moleküle sind gasförmig. Das bedeutet, dass auf der linken Seite insgesamt vier Gasteilchen sind und auf der rechten nur zwei. Was passiert jetzt, wenn wir den Druck erhöhen?
Eine Druckerhöhung löst aus, dass weniger Platz zur Verfügung steht. Die vier Teilchen auf der linken Seite werden im Vergleich zu den zwei Teilchen auf der rechten Seite extrem eingeengt. Das Gleichgewicht verschiebt sich somit auf die Seite, auf der die Teilchen weniger eingeengt sind (die rechte Seite). Analog dazu wird das Gleichgewicht bei Drucksenkung nach links verschoben.
Konzentration
Eine letzte Möglichkeit, das Gleichgewicht einer chemischen Reaktion zu verschieben, ist die Änderung von Konzentrationen. Betrachten wir dieselbe Reaktion wie bei der Druckänderung:
![]()
Hier liegt das Gleichgewicht stark auf der linken Seite (vgl. erste Beispiel – Berechnungen mit dem MWG). Wenn wir jetzt Ammoniak herstellen wollen, ist es nicht von Vorteil, wenn die Reaktion kaum abläuft. Wie können wir das Gleichgewicht also auf die rechte Seite verschieben?
Erhöhen wir die Konzentration eines Eduktes, beispielsweise des Stickstoffs, versucht das System diesem Überschuss an Stickstoff auszuweichen, indem die Reaktion so verstärkt abläuft, dass der überschüssige Stickstoff abgebaut wird.
Also wird die Reaktion auf die rechte Seite verschoben. Es ist auch möglich, die Konzentration des entstehenden Ammoniaks immer wieder zu verringern, indem wir das entstandene Ammoniak aus der Reaktion entfernen. Dann würde ein Ammoniakmangel vorliegen, welcher ausgeglichen werden muss. Auch hier wird das Gleichgewicht nach rechts verschoben, weil die Reaktion in diese Richtung verstärkt abläuft, in der wieder mehr Ammoniak hergestellt wird um den Mangel auszugleichen.
Katalysator
Wenn wir einen Katalysator bei einer Gleichgewichtsreaktion einsetzen, wird die Lage des Gleichgewichts nicht verändert. Mit dem Einsatz eines Katalysators können wir nur die Reaktionsgeschwindigkeit erhöhen, sodass sich das Gleichgewicht schneller einstellt.
Übersicht der Gleichgewichtsverschiebungen