
Puffer (Stoffgemisch)
Ein Puffer ist ein Stoffgemisch, welches seinen pH-Wert bei Zugabe von Säuren oder Basen deutlich weniger ändert als in ungepufferten Systemen. Puffer sind oft Stoffgemische aus schwachen Säuren und ihrer konjugierten Base oder aus schwachen Basen mit ihrer konjugierten Säure.
Vergleichen wir die pH-Wert-Änderung von einem Liter Wasser, wenn 0,1 mol Salzsäure hinzugegeben werden und von einem Liter Essigsäure-Acetat-Pufferlösung, bei derselben Stoffmengenzugabe.
| 0,1 mol Salzsäure in 1L Wasser | 0,1 mol Salzsäure in 1L Essigsäure-Acetat-Puffer |
|---|---|
| pH-Wert ändert sich von pH = 7 auf pH = 1 $\Rightarrow$ Große pH-Änderung | pH-Wert ändert sich von pH = 4,5 auf pH = 4,7 $\Rightarrow$ kaum eine pH-Änderung |
Der pH-Wert bleibt bei Pufferlösungen also relativ stabil. Das bedeutet, die Wirkung der Säuren bzw. Basen wird durch den Puffer geschwächt. Damit ein Puffer den pH-Wert konstant halten kann, muss er also selbst mit den Säuren bzw. Basen reagieren.
Schauen wir uns den Essigsäure-Acetat-Puffer mal genauer an. Hier werden Essigsäure (CH3COOH) und ihre konjugierte Base, das Acetat (CH3COO−) im Verhältnis 1:1 zusammengemischt. Hier können wir auch die Reaktionsgleichung des Protolysegleichgewichts aufstellen:
![]()
Mit dieser Gleichung und dem Wissen über Gleichgewichtsreaktionen und die Verschiebung des Gleichgewichts können wir nun die Pufferwirkung erklären:
1. Zugabe von Säuren
Geben wir zu der Pufferlösung eine Säure hinzu, entstehen mehr H3O+-Ionen. Das heißt, die Konzentration auf der rechten Seite wird erhöht und durch das Prinzip von Le Chatelier wird dadurch das Gleichgewicht auf die linke Seite verschoben und die Rückreaktion läuft verstärkt ab.
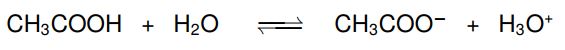
Die zusätzlichen Oxoniumionen werden abgebaut und die Konzentration ändert sich kaum. Wenn die Konzentration der Oxoniumionen sich nur kaum verändert, verändert sich auch der pH-Wert nur kaum.
2. Zugabe von Basen
Geben wir zu der Pufferlösung eine Base hinzu, entstehen mehr OH-Ionen. Diese reagieren mit der Essigsäure.
![]()
Die Hydroxidionen werden durch die Essigsäure fast vollständig abgebaut und reagieren daher nicht mit den H3O+-Ionen. Daher ändert sich diese Konzentration quasi nicht und daher auch der pH-Wert nicht.
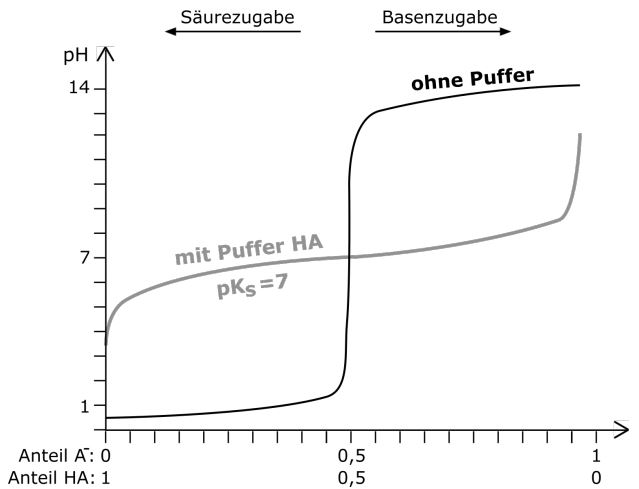
Betrachten wir nun die beiden pH-Wert-Änderungen von einer Lösung ohne Puffer und einer Lösung mit Puffer bei Zugabe von Säuren und Basen. Hier können wir ganz deutlich sehen, dass der pH-Wert mit einem Puffer sehr viel länger in einem ähnlichen pH-Wert-Bereich gehalten wird und nicht, wie bei der Lösung ohne Puffer, ein extremer pH-Wert-Sprung zu beobachten ist. In dem Bereich, in dem die pH-Wert-Kurve nur leicht ansteigt, liegt der sogenannte Pufferbereich des Puffers. Dieser Bereich ist für jeden Puffer unterschiedlich.
Aber wozu ist das Ganze jetzt eigentlich gut?
Puffer finden wir nicht nur im Labor, sondern vor allem auch bei Lebewesen. Die verschiedenen Enzyme und Proteine in unserem Körper sind nur bei bestimmten pH-Werten funktionsfähig. Da wir aber beim Essen und Trinken sowohl Säuren als auch Basen zu uns nehmen, würde sich der pH-Wert drastisch ändern und die Enzyme und Proteine wären nicht weiter funktionsfähig, was zum Tod führen würde. Daher befinden sich in unserem Körper Puffer, die den pH-Wert zwischen 7,3 und 7,45 halten. Bei pH-Werten unter 6,8 oder über 8,0 würden wir sterben.
Jetzt wissen wir, was Puffer sind, wie sie funktionieren und wieso sie so wichtig sind. Darüber hinaus ist es von großer Wichtigkeit, dass wir pH-Werte in Puffersystemen berechnen können. Auch hier gibt es eine Formel, die uns weiterhilft.
Henderson-Hasselbach-Gleichung
\begin{align*}
\text{pH }=\text{p}K_\text{S} + \lg \left( \frac{c({A^{-}})}{c({HA})} \right)
\end{align*}
Hier müssen wir unbedingt darauf achten, dass sich alle Werte der HendersonHasselbach-Gleichung auf den Puffer beziehen: Es werden also der pKS-Wert der Säure im Puffer, die Konzentration der Säure im Puffer und die Konzentration der konjugierten Basen im Puffer eingesetzt.
Beispiel: Betrachten wir einen Essigsäure-Acetat-Puffer, welcher aus 1 mol Essigsäure, 1 mol Natriumacetat und 1 L Wasser hergestellt wird. Berechnen wir nun den pH-Wert der Pufferlösung.
Wir benötigen den pKS-Wert der Essigsäure und die Konzentrationen von Essigsäure und dem Acetat. Da hier die Stoffmengen gegeben sind, müssen wir zunächst die Konzentrationen berechnen:
\begin{align*}
c({CH_3COOH}) &= \frac{n({CH_3COOH})}{V({CH_3COOH})} = \frac{1 \ {mol}}{1 \ {L}} = 1 \ \frac{ {mol}}{{L}} \\
c({CH_3COO^{-}}) &= \frac{n({CH_3COO^{-}})}{V({CH_3COO^{-}})} = \frac{1 \ {mol}}{1 \ {L}} = 1 \ \frac{{mol}}{{L}}
\end{align*}
Der pKS-Wert der Essigsäure liegt bei pKS = 4,76. Setzen wir nun diese Werte in die Henderson-Hasselbach-Gleichung ein:
\begin{align*}
\text{pH }= 4{,}76 + \lg \left( \frac{1 \ \frac{{mol}}{{L}}}{1 \ \frac{{mol}}{{L}}} \right) = 4{,}76 + \lg(1) =4{,}76
\end{align*}
Jetzt geben wir 0,1 mol Salzsäure hinzu und wollen den neuen pH-Wert berechnen. Wenn wir 0,1 mol Salzsäure hinzugeben, entstehen ca. 0,1 mol H3O+, daSalzsäure eine sehr starke Säure ist und daher quasi vollständig dissoziiert. Jetzt schauen wir uns die Wirkung des Puffers bei der Säurezugabe genauer an:
Durch die Zugabe der Säure entstehen Oxoniumionen, welche mit dem Acetat reagieren. Für ein Oxoniumion wird ein Acetat-Ion verbraucht. Daher werden durch die Zugabe von 0,1 mol Salzsäure 0,1 mol Acetat zur Reaktion gebracht. So entstehen 0,1 mol Essigsäure.
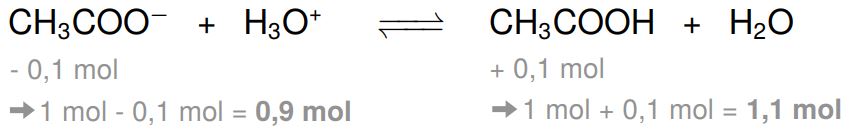
Nachdem der Puffer die Oxoniumionen also abgefangen hat, bleiben von den 1 mol Acetat noch 0,9 mol übrig und von der Essigsäure noch 1,1 mol. Mit den neuen Stoffmengen können wir die neuen Konzentrationen ausrechnen
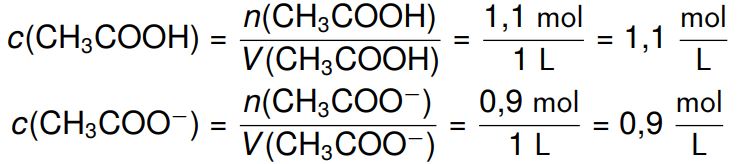
, welche wir dann in die Henderson-Hasselbach-Gleichung einsetzen können, um den pH-Wert zu berechnen:
\begin{align*}
\text{pH } = 4{,}76 + \lg \left( \frac{0{,}9 \ \frac{{mol}}{{L}}}{1{,}1 \ \frac{{mol}}{{L}}} \right) = 4{,}67
\end{align*}