Elektronegativität
Unter Elektronegativität (kurz: EN) eines Elementes verstehen wir ein Maß dafür, wie stark die Atome dieses Elementes gemeinsame Bindungselektronen anziehen.
Neu!
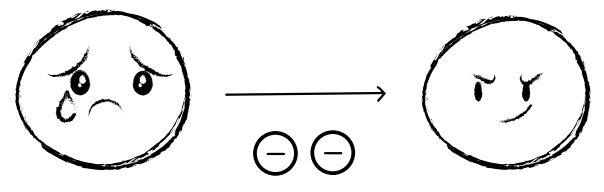
Wir können einen Vergleich zum Tauziehen herstellen: Wenn eine der beiden Personen, die an dem Tau ziehen, stärker ist, zieht sie das Fähnchen in der Mitte näher zu sich. Auf die Teilchenebene übertragen, ist die stärkere Person das Atom mit der höheren Elektronegativität, welches die Elektronen in einer Bindung näher zu sich zieht.
Jedes Element hat eine unterschiedliche Elektronegativität. Die Elektronegativität nimmt innerhalb einer Periode (von links nach rechts) zu und innerhalb einerGruppe (von oben nach unten) ab. Daraus ergibt sich, dass Fluor das Element mit der höchsten Elektronegativität ist. Warum steht dann nicht das Element Helium ganz rechts oben? Das liegt daran, dass die Gruppe der Edelgase bereits ein Oktett besitzt und somit keine Verbindungen eingeht.
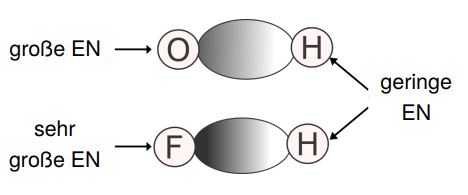
Sobald zwei unterschiedliche Atome durch ein bindendes Elektronenpaar miteinander verbunden sind, werden die Elektronen also stets zu dem elektronegativeren Atom hingezogen. Auf diese Weise ergibt sich eine asymmetrische Ladungsverteilung. Diese Bindung nennen wir polar. Je stärker die Elektronen von einem Atom angezogen werden, umso polarer ist eine Bindung.
Bei einer Bindung zwischen zwei gleichen Atomen wird gleich stark an den Elektronen des bindenden Elektronenpaares gezogen, wodurch sich eine symmetrische Ladungsverteilung der Bindung ergibt. Hier sprechen wir von einer unpolaren Bindung.
Neu!
Es existieren jedoch auch Bindungen, deren Elektronegativität sich kaum unterscheidet, weshalb wir dann nicht von einer polaren Bindung sprechen können. Um zu entscheiden, ob eine Bindung polar ist, benötigen wir die sogenannte Elektronegativitätsdifferenz. Dazu ziehen wir die Elektronegativität des einen Atoms von der Elektronegativität des anderen Atoms ab.
Elektronegativitätsdifferenz
\begin{align*}
\Delta \text{EN} = | \text{EN}_{\text{Element 1}} – \text{EN}_{\text{Element 2}}|
\end{align*}
Im Allgemeinen ergibt sich folgende Entscheidungsregel
\begin{align*}
& & \Delta EN & > & \text{1,7 Ionenbildung} \\
0{,}4 & < & \Delta EN & < & \text{1,7 polare Elektronenpaarbindung} \\
& & \Delta EN & < & \text{0,4 unpolare Elektronenpaarbindung}
\end{align*}
Für die Verständlichkeit schauen wir uns einige Beispiele an:
\begin{align*}
\text{Natriumchlorid NaCl} \ & \Delta\text{EN } = 4-0{,}9 = 3{,}1 & \Rightarrow Ionenbindung \\
\text{Magnesiumoxid MgO} \ & \Delta\text{EN } = 3{,}44-1{,}31 = 2{,}13 & \Rightarrow Ionenbindung \\
\text{Wasserstoff H2} \ & \Delta\text{EN } = 2{,}2-2{,}2 = 0 & \Rightarrow unpolare Bindung \\
\text{C-H-Bindung} \ & \Delta\text{EN } = 2{,}55-2{,}2 = 0{,}35 & \Rightarrow unpolare Bindung \\
\text{O-H-Bindung} \ & \Delta\text{EN } = 3{,}44-2{,}2 = 1{,}24 & \Rightarrow polare Bindung
\end{align*}