
Massenwirkungsgesetz
Auf dieser Seite erklären wir euch das Massenwirkungsgesetz. Schau dir zur Grundlage den Artikel Chemisches Gleichgewicht an.
Wir haben ein nicht-chemisches Beispiel und eine chemische Beispielreaktion genauer betrachtet, jedoch fehlt uns noch eine allgemeingültige Aussage, die auf jede beliebige umkehrbare Reaktion anwendbar ist. Daher betrachten wir nun eine ganz allgemeine Reaktion:
\begin{align*}
aA + bB <=> dD + eE
\end{align*}
Die kleinen Buchstaben sind die Koeffizienten (geben die Anzahl der jeweiligen Teilchen an), die Großbuchstaben stellen ein beliebiges Teilchen dar.
\begin{align*}
K_c = \frac{C_{\text{GG}}(\text{Produkte})}{C_{\text{GG}}(\text{Edukte})} = \frac{c({D})^d \cdot c({E})^e}{c({A})^a \cdot c({B})^b}
\end{align*}
Diese Formel wird auch Massenwirkungsgesetz (kurz: MWG) genannt. Die Gleichgewichtskonstante gibt Aufschluss auf die Lage des Gleichgewichts. Ist die Gleichgewichtskonstante
- Kc > 1, liegen mehr Produkte als Edukte vor und das Gleichgewicht liegt
auf der rechten Seite oder - Kc < 1, gibt es mehr Edukte als Produkte und das Gleichgewicht liegt auf der linken Seite.
-
Diese Formel wird auch Massenwirkungsgesetz (kurz: MWG) genannt. Die Gleichgewichtskonstante gibt Aufschluss auf die Lage des Gleichgewichts.
- Aufstellen der Reaktionsgleichung.
- Formulieren des MWG für die Reaktion.
- Gesuchte und gegebene Größen ermitteln.
- Wichtig: Im MWG stehen nur Konzentrationen während des Gleichgewichtszustands, keine Anfangskonzentrationen.
- Sollten Anfangskonzentrationen gegeben sein, leiten wir die Stoffmengenverhältnisse aus der Reaktionsgleichung ab und berechnen daraus die GG-Konzentrationen.
- Einsetzen aller gegebenen Größen in das MWG.
- Auflösen nach gesuchter Größe.
Zur besseren Veranschaulichung sehen wir uns zwei Beispiele an. Beispiel: In einem Zylinder mit einem Liter Volumen werden 8 mol Wasserstoff und 5 mol Stickstoff zur Reaktion gebracht, wobei Ammoniak in einer Konzentration von 2,5 mol=L entsteht. Berechne die Gleichgewichtskonstante Kc.
- Aufstellen der Reaktionsgleichung
\begin{align*}N_2 + 3H_2 <=> 2NH_3 \end{align*} - Sobald wir die Reaktionsgleichung kennen, können wir daraus das MWG für diese Reaktion formulieren:
\begin{align*} K_c = \frac{c({NH3})^2}{c({N2})^1 \cdot c({H2})^3} \end{align*} - Jetzt ermitteln wir die gesuchte Größe (Gleichgewichtskonstante) unter Berücksichtigung der gegebenen Werte.
Bekannt: \begin{align*} V=1\ {L}, n_0{H_2}=8\ {mol},n_0{N_2}=5\ {mol},c({NH_3})=2{,}5 \ {mol}/{L} \end{align*}
Um das MWG verwenden zu können, benötigen wir jeweils die Konzentrationen im Gleichgewichtszustand. Die von Ammoniak ist bereits gegeben. Um die von Wasserstoff und Stickstoff zu ermitteln, berechnen wir zunächst die Anfangskonzentrationen aus den anfänglichen Stoffmengen:
\begin{align*}
c_o({H2}) = \frac{8\ {mol}}{1\ {L}} = 8\ \frac{{mol}}{{L}} \quad \text{und} \quad
c_o({N2}) = \frac{5\ {mol}}{1\ {L}} = 5\ \frac{{mol}}{{L}}
\end{align*}Um jetzt herauszufinden, wie viel Wasserstoff und Stickstoff nach Einstellung des Gleichgewichts noch vorhanden sind, benötigen wir zunächst die jeweiligen Stoffmengenverhältnisse zum entstehenden Ammoniak.
\begin{align*}
\frac{n({H_2})}{n({NH_3})} = \frac{3}{2} \Rightarrow n({H_2}) = \frac{3}{2} \cdot n({NH_3})
\end{align*}
Die Stoffmenge an Wasserstoff, die wir für die Herstellung von Ammoniak benötigen, ist also 1,5-mal so groß wie die Stoffmenge des entstehenden Ammoniaks.
\begin{align*}
\frac{n({N_2})}{n({NH_3})} = \frac{1}{2} \Rightarrow n({N_2}) = \frac{1}{2} \cdot n({NH_3})
\end{align*}Die Stoffmenge an Stickstoff, die wir für die Herstellung von Ammoniak benötigen, ist 0,5-mal so groß wie die Stoffmenge des entstehenden Ammoniaks.
Diese Zusammenhänge können wir auf die Konzentrationen übertragen, da alles bei gleichem Volumen vorliegt:\begin{align*}
c_\text{Verbrauch}({H_2}) = \frac{3}{2} \cdot c({NH_3}) \quad \text{und} \quad
c_\text{Verbrauch}({N_2}) = \frac{1}{2} \cdot c({NH_3})
\end{align*}Da wir jetzt wissen, wie viel Wasserstoff und Stickstoff bei dieser Reaktion verbraucht werden, können wir berechnen, wie viel noch übrig bleibt:
\begin{align*}
c_\text{GG}({H2}) &= c_0({H2}) – c_\text{Verbrauch}({H2}) = 8\ \frac{{mol}}{{L}} – \frac{3}{2} \cdot 2{,}5\ \frac{{mol}}{{L}} = 4{,}25\ \frac{{mol}}{{L}} \\
c_\text{GG}({N2}) &= c_0({N2}) – c_\text{Verbrauch}({N2}) = 5\ \frac{{mol}}{{L}} – \frac{1}{2} \cdot 2{,}5\ \frac{{mol}}{{L}} = 3{,}75\ \frac{{mol}}{{L}}
\end{align*} - Jetzt setzen wir die Konzentrationen in das Massenwirkungsgesetz ein:
\begin{align*}
K_c = \frac{\left( 2{,}5\ \frac{{mol}}{{L}} \right)^2}
{\left( 4{,}25\ \frac{{mol}}{{L}} \right)^3 \cdot 3{,}75 \ \frac{{mol}}{{L}}} = 0{,}022
\end{align*}Mit der Gleichgewichtskonstante können wir jetzt bestimmen, auf welcher Seite das Gleichgewicht liegt. Da Kc<1, liegt das Gleichgewicht auf der linken Seite (wir haben also mehr Edukte als Produkte). Beispiel:
Die Gleichgewichtskonstante der Reaktion von Wasserstoff und Iod zu Wasserstoffiodid liegt bei T=448i°C bei Kc=51. In einem Zylinder mit 2L Volumen werden 3mol Wasserstoff und 2mol Iod zur Reaktion gebracht. Berechne die Konzentrationen der Produkte und Edukte, die vorliegen, wenn sich das chemische Gleichgewicht eingestellt hat. - Aufstellen der Reaktionsgleichung
\begin{align*}
{H_2 + I_2 \leftrightarrow 2HI}
\end{align*} - Formulieren des MWG für die Reaktion:
\begin{align*}
K_c = \frac{c({HI})^2} {c({H_2})^1 \cdot c({I_2})^1}
\end{align*} - Jetzt ermitteln wir die gesuchte Größe, hier: \begin{align*} c_\text{GG}({HI}),c_\text{GG}({H_2}) \text{und} c_\text{GG}({I_2}) \end{align*} unter Berücksichtigung der gegebenen Werte. Bekannt: \begin{align*}{K_c=51}, n_0({H_2})=3\ {mol},n_0({I_2})=2\ {mol},V=2 \ {L} \end{align*}
Auch hier müssen wir uns wieder überlegen, wie viel der jeweiligen Stoffe nach Einstellung des chemischen Gleichgewichts vorliegt. Da wir nicht wissen, wie viel Wasserstoffiodid entsteht (anders als beim vorherigen Beispiel), vergeben wir hierfür die Variable x. Nun stellen wir, wie im vorherigen Beispiel, die Stoffmengen- bzw. Konzentrationsverhältnisse auf:
\begin{align*}
\frac{n({H_2})}{n({HI})} &= \frac{1}{2} \Rightarrow n({H_2}) = \frac{1}{2} \cdot n({HI}) \Rightarrow c_\text{Verbrauch}({H_2}) = \frac{1}{2} \cdot c_\text{GG}({HI}) \\
\frac{n({I_2})}{n({HI})} &= \frac{1}{2} \Rightarrow n({I_2}) = \frac{1}{2} \cdot n({HI}) \Rightarrow c_\text{Verbrauch}({I_2}) = \frac{1}{2} \cdot c_\text{GG}({HI})
\end{align*}
Der Übersicht wegen stellen wir die Anfangskonzentrationen und die Konzentrationen im Gleichgewicht (ohne Einheiten) in einer Tabelle dar:
- Einsetzen aller gegebenen Größen in das MWG
Die Werte aus der Tabelle können wir jetzt gemeinsam mit dem Wert der Gleichgewichtskonstante Kc in das MWG einsetzen.
\begin{align*}
51 = \frac{x^2}{(1{,}5 – \frac{1}{2} \cdot x) \cdot (1-\frac{1}{2}\cdot x )}
\end{align*} -
Wir fassen zusammen und lösen nach gesuchter Größe, in diesem Fall x, auf:
\begin{align*}
\begin{array}{crcll}
%& 51 &=& \frac{x^2}{1{,}5 – 0{,}5 x – 0{,}75 x + 0{,}25x^2} & \\
& 51 &=& \frac{x^2}{ 0{,}25x^2 – 1{,}25 x + 1{,}5} & |\cdot (0{,}25x^2 – 1{,}25 x + 1{,}5) \\
\Leftrightarrow & 51\cdot (0{,}25x^2 – 1{,}25 x + 1{,}5) &=& x^2 & \\
\Leftrightarrow & 12{,}75x^2 – 63{,}75 x + 76{,}5 &=& x^2 & |-x^2 \\
\Leftrightarrow & 11{,}75x^2 – 63{,}75 x + 76{,}5 &=& 0 &
\end{array}
\end{align*}
Es liegt jetzt eine quadratische Gleichung in Normalform vor, welche wir mit der Mitternachtsformel (pq-Formel ist auch möglich, aber dafür muss die Gleichung zunächst durch 11,75 geteilt werden) lösen:
\begin{align*}
x_{1,2} = \frac{63{,}75 \pm \sqrt{63{,}75^2 – 4 \cdot 11{,}75 \cdot 76{,}5}}{2 \cdot 11{,}75} \Rightarrow x_1 = 3{,}63 \wedge x_2 = \underline{\underline{1{,}79}}
\end{align*}
Für die entstehende und im Gleichgewicht vorliegende Wasserstoffiodid-Konzentration haben wir zuvor die Variable x festgelegt. Wir setzen die möglichen Werte für x in die Tabelle ein und sehen schnell, welcher Wert der korrekte ist.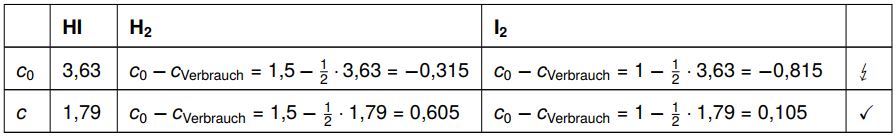
Bei der ersten Lösung würden sich negative Konzentrationen für Wasserstoff und Iod bei Einstellung des Gleichgewichts ergeben. Da eine Konzentration niemals negativ sein kann, ist dieses Ergebnis falsch. Bei der zweiten Lösung erhalten wir hierfür positive Werte. Also kann nur die zweite Lösung richtig sein.
Wir kennen also jetzt alle gesuchten Konzentrationen:
\begin{align*}
c_\text{GG}({HI})=1{,}79 \ \frac{{mol}}{{L}}, \quad c_\text{GG}({H_2}) = 0{,}605 \ \frac{{mol}}{{L}}, \quad c_\text{GG}({I_2}) = 0{,}105 \ \frac{{mol}}{{L}}
\end{align*}