
Elektrolyse
Die Elektrolyse ist ein Prozess, bei dem durch elektrischen Strom eine Redoxreaktion erzeugt wird. In diesem Artikel schauen wir uns die Reaktionen, die bei der Elektrolyse ablaufen, etwas genauer an:
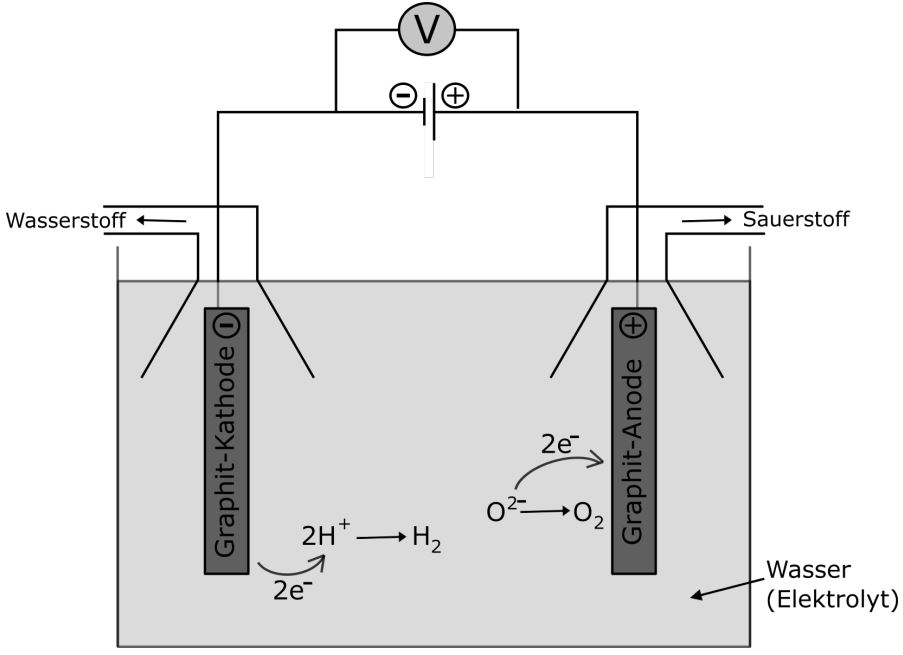
Die Wasserteilchen werden mithilfe von Strom in Sauerstoff und Wasserstoff zersetzt. Schauen wir uns die Reaktionen an, die an Kathode und Anode ablaufen. An der Kathode reagiert Wasser zu Wasserstoff (es handelt sich um eine Reduktion, da die Oxidationszahl des Wasserstoffatoms im Wassermolekül +I ist und im Wasserstoffmolekül 0). An der Anode reagiert Wasser zu Sauerstoff (es handelt sich hier um eine Oxidation, da die Oxidationszahl des Sauerstoffatoms im Wassermolekül -II und im Sauerstoffmolekül 0 ist).
\begin{array}{llcl}
Kathode/Red.: &{2H_2O} \ + \ {2e^{-}} \quad \rightarrow \quad {H_2} \ + \ {2OH^{-}} \\
Anode/Ox.: & {2H_2O} \quad \rightarrow \quad \ {O_2} + \ {4H^{+}} \ + \ {4e^{-}}
\end{array}
Damit wir die beiden Reaktionen jetzt zu einer Gesamtreaktion zusammenfassen können, muss hier wieder die Anzahl der Elektronen bei beiden Teilgleichungen übereinstimmen. Die Reaktion an der Kathode muss also mit zwei multipliziert werden:
\begin{array}{llcl}
\text{Kathode/Red.:} & {2H_2O} \ + \ {2e^{-}} ; \quad \rightarrow \quad {H_2}+ \ {2OH^{-}} \quad |\cdot 2 \\
& {4H_2O} \ + \ {4e^{-}} \quad \rightarrow \quad \ {2H_2} \ + \ {4OH^{-}}
\end{array}
Jetzt können wir die beiden Teilgleichungen zu einer Gesamtgleichung zusammenfassen:
\begin{align*}
{4H_2O} \ + \ {4e^{-}}\ + \ {2H_2O} \quad \rightarrow \quad {2H_2} \ + \ {4OH^{-}} \ + \ {O_2} \ + \ {4H^{+}} \ + \ {4e^{-}}
\end{align*}
Jetzt werden noch die Elektronen rausgestrichen:
\begin{align*}
{4H_2O} \ + \ {2H_2O} \quad \rightarrow \quad {2H_2} \ + \ {4OH^{-}}\ + \ {O_2} \ + \ {4H^{+}}
\end{align*}
Eine Elektrolyse ist eine chemische Reaktion, bei der durch elektrische Energie eine Redoxreaktion erzwungen wird. Dabei wird eine chemische Verbindung zersetzt. Es wird elektrische Energie in chemische Energie umgewandelt.
Die Elektrolyse ist also auch der Vorgang, der beim Laden eines Akkus stattfindet. Im Prinzip handelt es sich dabei um die Umkehrung eines galvanischen Elements. Der Aufbau bei einer Elektrolyse ist dem eines galvanischen Elements sehr ähnlich: zwei Elektroden werden in eine Lösung, den Elektrolyten, eingetaucht. Dann wird, anders als beim galvanischen Element, Gleichstrom angelegt, wodurch wir einen Plus- und einen Minuspol haben. Betrachten wir beispielsweise eine Zinkiodid-Lösung mit zwei Graphitelektroden:
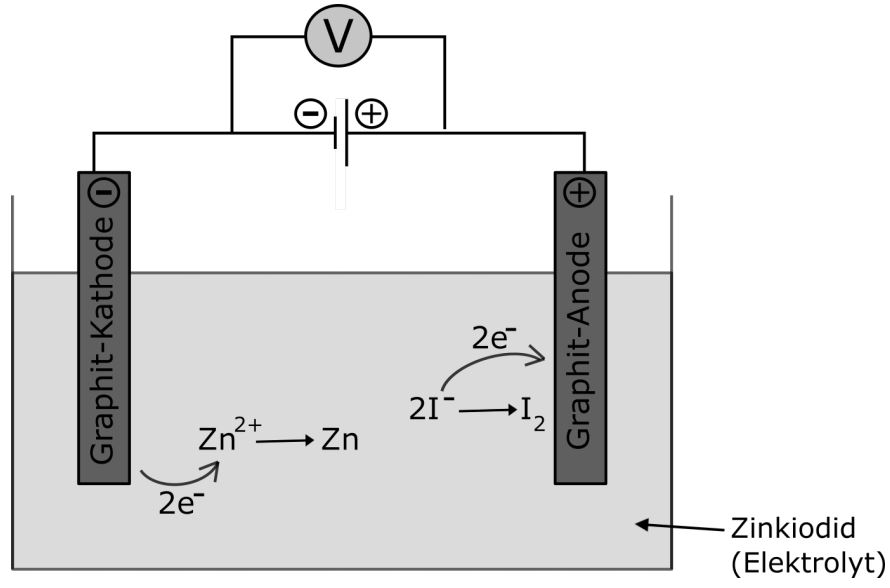
Die negative Elektrode zieht positive Teilchen an, also hier die Zn2+-Ionen. Es werden Elektronen von der Elektrode an die Zink(II)-Ionen abgegeben, wodurch elementares Zink entsteht. Die positive Elektrode zieht negative Teilchen an, also hier die I-Ionen. Diese können nun ihre Elektronen an die Anode abgeben, wodurch elementares Iod entsteht.
Jetzt liegt hier aber nicht nur Zinkiodid vor, sondern auch Wasser, welches durch Elektrolyse zu Wasserstoff und Sauerstoff zersetzt werden kann. Wie können wir nun entscheiden, welche der beiden Elektrolysen abläuft? Hierbei können wir uns wieder der elektrochemischen Spannungsreihe bedienen. Es findet immer zuerst die Elektrolyse von Stoffen mit betragsmäßig kleineren Potenzialen statt.
Vergleichen wir Zinkiodid und Wasser:
\begin{array}{l|l|l}
\text{Elektrolyse von} \dots & \text{Reaktionsgleichungen} & \text{Standardpotenzial} \\
\hline
\dots \text{Wasser} & \ {2H_2O} \ + \ {2e^{-}} \quad \rightarrow \quad {H_2} \ + \ {2OH^{-}} \ & \text{-0,83} \ {V} \\
& \ {O_2} \ + \ {4H^{+}} \ + \ {4e^{-}} \quad \rightarrow \quad {2H_2O} & \text{+1,23} \ {V}\\
\hline
\dots Zinkiodid & \ {Zn^{2+}} \ + \ {2e^{-}} \quad \rightarrow \quad {Zn} & \text{-0,76} \ {V} \\
& \ {2I^{-}} \quad \rightarrow \quad {I_2} \ + \ {2e^{-}} \ & +0{,}53 \ {V}\\
\end{array}
Die Standardpotenziale bei der Zersetzung von Zinkiodid sind betragsmäßig kleiner als die bei der Zerlegung von Wasser. Daher läuft die Elektrolyse von Zinkiodid zuerst ab.
Wenn wir nun sichergehen wollen, dass wirklich nur die Elektrolyse von Zinkiodid abläuft, können wir auch eine niedrige Spannung anlegen, sodass sie gerade ausreicht, um Zinkiodid zu zersetzen. Wie hoch muss diese Spannung sein?
Das berechnen wir wieder wie bei der galvanischen Zelle – das kleinere Standardpotenzial wird von dem größeren Standardpotenzial abgezogen:
\begin{align*}
0,53 V − (−0,76 V) = +1,29 V
\end{align*}
Das bedeutet, wir legen eine Spannung von 1,29 V an, was gerade ausreicht, um Zinkiodid zu zersetzen, aber nicht für die Elektrolyse von Wasser (hier müsste eine Spannung von mind. 2,06 V angelegt werden).
Jetzt kommen wir noch zu einem besonderen Phänomen bei der Elektrolyse. Wir wissen ja bereits, wie wir die notwendige Spannung berechnen, damit die Elektrolyse abläuft. Manchmal passiert beim Anlegen der berechneten Spannung aber leider gar nichts. Erst bei einer höheren Spannung läuft die Elektrolyse ab. Die Spannung, die zusätzlich zum errechneten Wert angelegt werden muss, nennen wir Überspannung oder Überpotenzial.
Diese Überspannung hängt von verschiedenen Faktoren ab:
- Art und Oberflächenbeschaffenheit der Elektrode
- Art und Konzentration der Ionen
- Temperatur und Stromdichte
Entstehen bei der Elektrolyse Metalle, ist die Überspannung geringer, als bei Elektrolysen, bei denen Gase entstehen.