
Zwischenmolekulare Wechselwirkungen
In diesem Artikel geht es um Wasserstoffbrückenbindungen und verschiedene Arten von Van-der-Waals-Wechselwirkungen, welche unter dem Begriff zwischenmolekulare Wechselwirkungen zusammengefasst werden. Vor allem spielen Wasserstoffbrückenbindungen eine bedeutende Rolle in der Natur. Die für die Entwicklung des Lebens auf der Erde wichtige Anomalie des Wassers ist maßgeblich auf
Wasserstoffbrücken zwischen den Molekülen zurückzuführen.
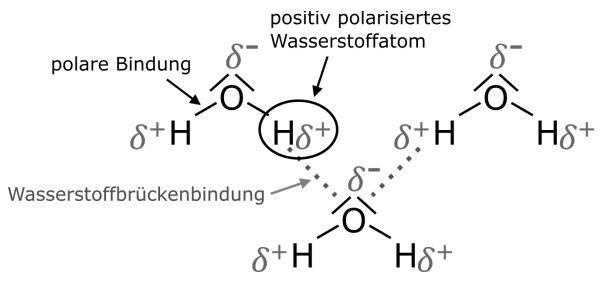
Wasserstoffbrückenbindungen
Wasserstoffbrückenbindungen stellen zwischenmolekulare Wechselwirkungen zwischen einem positiv polarisierten Wasserstoffatom und einem freien Elektronenpaar dar. Es handelt sich hierbei um die stärksten zwischenmolekularen Wechselwirkungen.
Dipol-Dipol-Wechselwirkungen
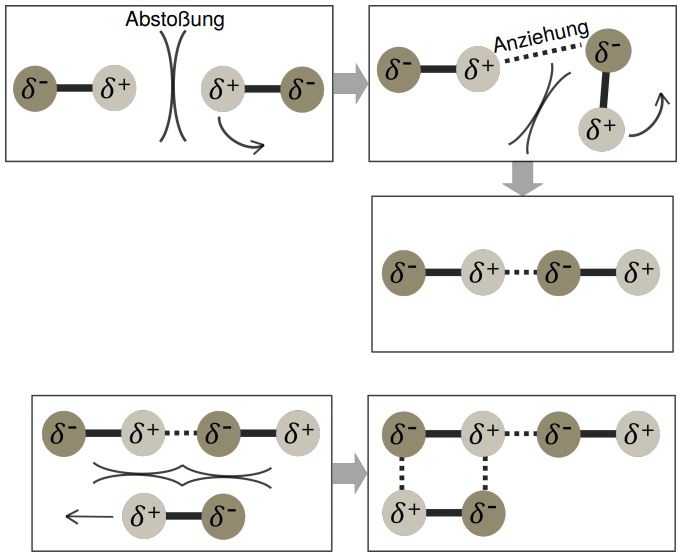
Dipol-Dipol-Wechselwirkungen sind zwischenmolekulare Wechselwirkungen zwischen permanenten Dipolen (positiven und negativen Partialladungen). Sie treten demnach bei Molekülen auf, bei denen der positive Ladungsschwerpunkt nicht mit dem negativen Ladungsschwerpunkt zusammenfällt.
Van-der-Waals-Kräfte
Van-der-Waals-Kräfte sind zwischenmolekulare Wechselwirkungen zwischen ständig wechselnden spontanen und induzierten Dipolen.
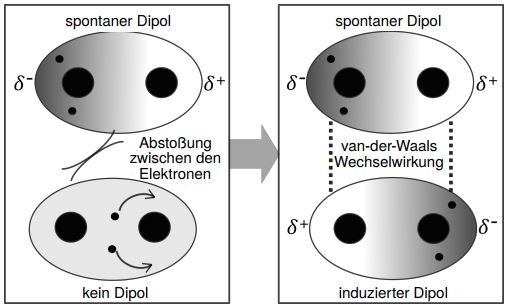
Spontane Dipole entstehen durch die ständige Bewegung der Elektronen. Dabei kann es passieren, dass beide Elektronen sich gleichzeitig mehr bei einem der beiden Atome aufhalten. Der spontane Dipol wirkt sich nun auch auf die umliegenden Moleküle aus.
Da sich Elektronen gegenseitig abstoßen, werden die Elektronen in einem umliegenden Molekül durch die Elektronen des spontanen Dipols abgestoßen und zu dem entgegengesetzten Atom gelenkt. Dadurch entsteht ein weiterer Dipol, welchen wir induzierten Dipol nennen. Jetzt liegt eine Dipol-Dipol-Wechselwirkung vor. Die van-der-Waals Wechselwirkungen sind schwächer als Dipol-Dipol-Wechselwirkungen, da die entstandenen Dipole durch die Bewegung der Elektronen nicht dauerhaft sind und wieder unpolare Moleküle resultieren.