Aldehyde und Ketone
Aldehyde und Ketone sind Moleküle mit einer funktionellen Carbonylgruppe (=O). Bei Aldehyden ist, im Gegensatz zu den Ketonen, am Carbonylkohlenstoffatom neben einem organischen Rest auch ein Wasserstoffatom gebunden. Bei den Ketonen sind am Carbonylkohlenstoffatom zwei organische Reste gebunden. Die Strukturformel von Aldehyd und Keton sehen wie folgt aus:

Themen auf dieser Seite zu Aldehyde und Ketone
- Schmelz- und Siedepunkte von Aldehyden und Ketonen
- Löslichkeit von Aldehyden und Ketonen
- Reaktionsverhalten von Aldehyden und Ketonen
- Silberspiegelprobe
- Fehling-Probe
Neu!
Schmelz- und Siedepunkte von Aldehyde und Ketonen
Auch hier gelten, wie bereits bei den Alkanen beschrieben, die gleichen Zusammenhänge zwischen Schmelz-, Siedepunkt und den zwischenmolekularen Wechselwirkungen.
Bezüglich der van-der-Waals-Wechselwirkungen gelten die gleichen Entscheidungsregeln, die wir schon bei den Kohlenwasserstoffen beschrieben haben. Im Gegensatz zu den Alkoholen gibt es keine Wasserstoffbrückenbindungen, da keine Wasserstoffatome an „sehr elektronegative“ Atome gebunden sind.
Neu!
Zusätzlich zu den van-der-Waals-Wechselwirkungen finden Dipol-Dipol-Wechselwirkungen statt. Diese Wechselwirkungen können stattfinden, da es sich sich bei Aldehyden und Ketonen um polare Moleküle handelt. Eine Folge dessen ist, dass Schmelz- und Siedepunkte bei Aldehyden und Ketonen höher sind, als bei Kohlenwasserstoffen.
Löslichkeit von Aldehyden und Ketonen
Die Carbonylgruppe von Aldehyden und Ketonen ist polar. Die Löslichkeit in polaren Lösungsmitteln hängt von der Länge des unpolaren organischen Rests ab. Je größer die Kohlenwasserstoffkette ist, desto größer ist der unpolare Teil des Moleküls und das Molekül löst sich zunehmend besser in unpolaren Lösungsmitteln, wie z.B. Benzin. Je kürzer die Kohlenwasserstoffkette ist, desto kleiner wird der unpolare Teil des Moleküls und es löst sich zunehmend besser in polaren Lösungsmitteln wie Wasser.
Reaktionsverhalten von Aldehyden und Ketonen
Nucleophile Addition
Aldehyde und Ketone können mit einem Nucleophil in einer nucleophilen Addition reagieren.
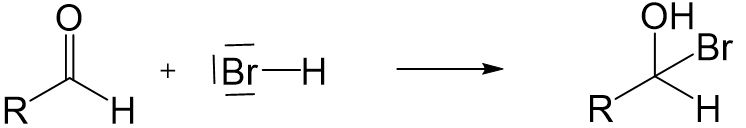
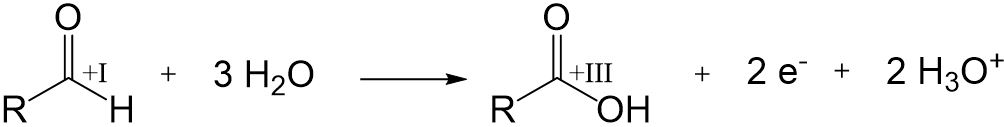
Oxidation
Aldehyde können mithilfe eines Oxidationsmittels in einer Oxidation zu einer Carbonsäure reagieren.
Unterscheidung von Aldehyden und Ketonen: Nachweisreaktionen
Um nachzuweisen, ob es sich bei einer Carbonylverbindung um einen Aldehyd oder ein Keton handelt, nutzt man die Tatsache, dass Aldehyde oxidiert werden können, Ketone hingegen nicht.
Es gibt zwei verschiedene Nachweisreaktionen: die Silberspiegelprobe und die Fehlingprobe. Bei beiden Nachweisen werden Oxidationsmittel eingesetzt. Findet eine Reaktion statt, so handelt es sich um einen Aldehyd, findet keine Reaktion statt, so handelt es sich um ein Keton.
Neu!
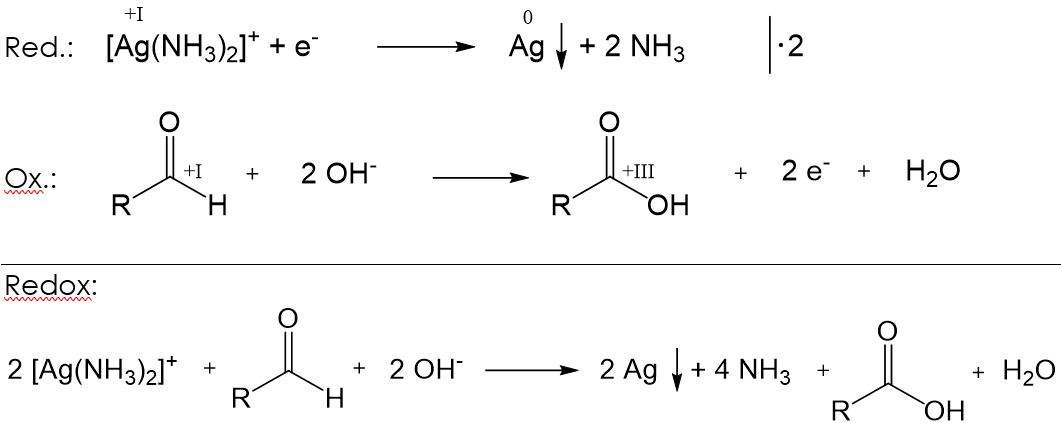
Silberspiegelprobe
Bei der Silberspiegelprobe wird eine ammoniakalische Silbernitratlösung zu der Probe gegeben und anschließend erhitzt. Ist in der Probe ein Aldehyd enthalten, so entsteht elementares Silber, welches sich an der Glaswand als Silberspiegel absetzt. Dabei laufen folgende Teilreaktionen ab:
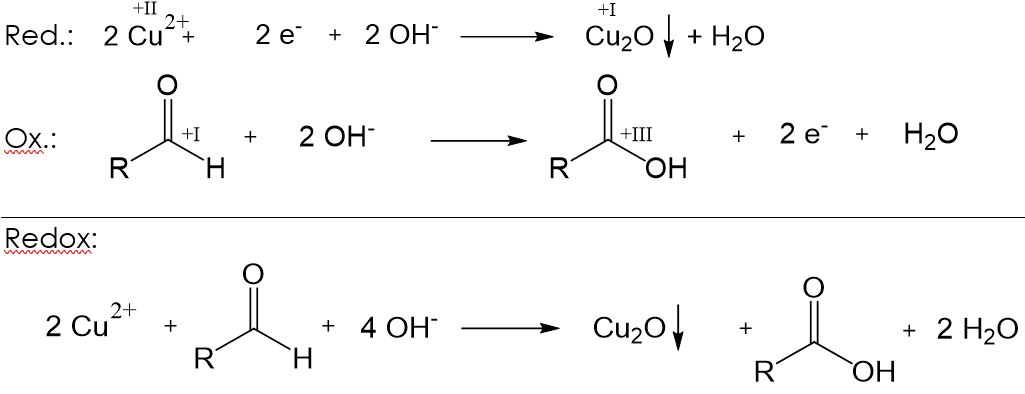
Fehling-Probe
Bei dieser Nachweisreaktion werden eine wässrige Kupfer(II)-sulfat-Lösung („Fehling I“) und verdünnte Natronlauge, welche mit Kaliumnatriumtatrat versetzt ist, („Fehling II“) zusammengemischt. Anschließend wird etwas von der Probe hinzugegeben und das Gemisch erhitzt. Ist in der Probe ein Aldehyd enthalten, so färbt sich die Lösung ziegelrot. Dabei laufen folgende Teilreaktionen ab: