Elektrophile Addition
Bei einer Elektrophilen Addition handelt es sich um eine chemische Reaktion, bei der ein Elektrophil (das reagierende Teilchen) mit einem Nukleophil (dem Reaktionspartner) reagiert. Bei dieser Reaktion greift ein äußerst positiv geladenes Teilchen die Elektronen anderer Atome an, um sie für sich zu gewinnen.
Neu!
Wie die Elektrophile Reaktion im Detail abläuft zeigen wir euch anhand eines Beispiels, bei dem wir Brom (Elektrophil) mit Ethen (Nukleophil) reagieren lassen
Wichtige Grundlage
- Elektrophile weisen einen Elektronenmangel vor
- Elektrophile sind Teilchen mit hoher positiver Ladung
- Elektrophile sind ungesättigte Kohlenwasserstoffe
- Elektrophile weisen einen Elektronenmangel vor
Beispiel Elektrohpile Addition
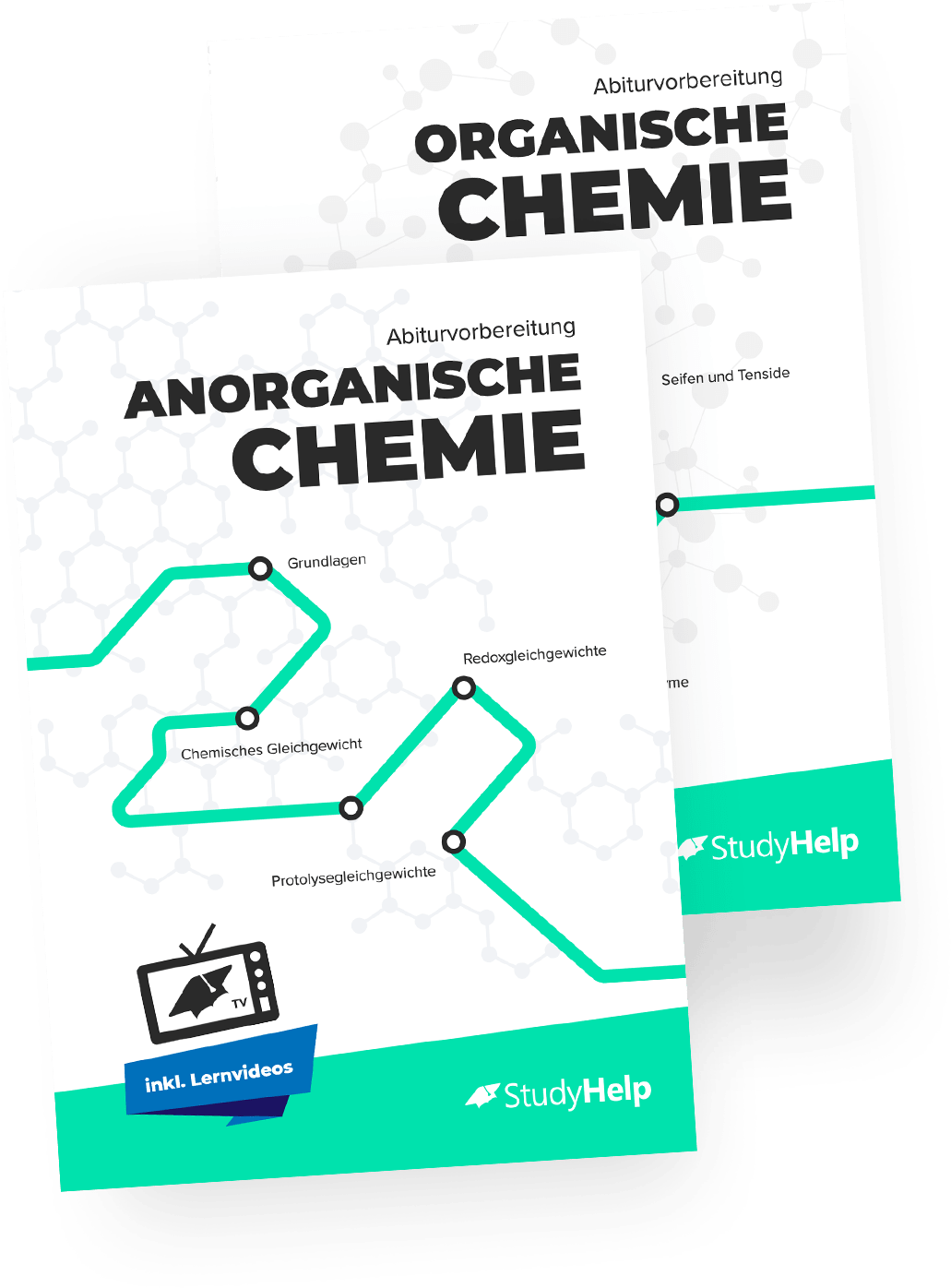
Die Elektronendichte bei einer Doppelbindung ist deutlich höher als die Elektronendichte einer Einfachbindung. Dadurch entsteht eine Wechselwirkung des Ethens mit dem Brommolekül. Diese Wechselwirkung hat zur Folge, dass die Elektronen im Brommolekül verschoben werden. Der Grund, warum sie sich verschieben, ist simpel: In der Doppelbindung des Ethens- und auf der äußeren Schale des Bromatoms befinden sich viele Elektronen. Nähern sich jetzt Ethen und Brom räumlich gesehen an, so stoßen sich die Elektronen gegenseitig ab, da sie gleich geladen sind. Dies hat zur Folge, dass sich die Elektronen in den rechten Teil des Brommoleküls zurückziehen, wodurch im linken Teil des Moleküls eine positive Ladung zurückbleibt. (Wir erinnern uns: Positive Ladung bedeutet, dass auf der äußersten Schale des Atoms freie Plätze für Elektronen zu vergeben sind)
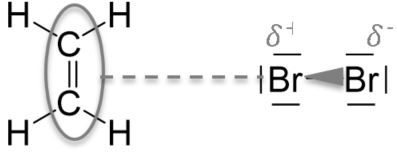
Nun tritt ein grundlegendes Prinzip der organischen Chemie in Kraft: Die positive Partialladung am linken Bromatom muss durch ein Elektronenpaar ausgeglichen werden. Jetzt stellt sich die Frage, woher wir dieses Elektronenpaar nehmen können? Ein freies Elektronenpaar steht zwar nicht zur Verfügung, jedoch eine Doppelbindung im Ethen. Aus dieser Doppelbindung verwenden wir ein Elektronenpaar um den Elektronenmangel des Bromatoms auszugleichen.
Das Elektronenpaar kann zum jetzigen Zeitpunkt jedoch noch nicht am Bromatom angreifen, da die maximale Anzahl an Elektronen (acht) die äußere Schale des Atoms besetzt. Somit ist „kein Steckplatz“ frei. Um einen freien Platz zu schaffen, muss die Bindung zum anderen Bromatom aufgebrochen werden. Das Brommolekül wird hier also heterolytisch gespalten (ungleichmäßige Aufteilung der Elektronen).
Bei jedem Reaktionsschritt sollte überprüft werden, ob Ladungen entstanden sind: dazu werden die Elektronen gezählt, die direkt am Atom anliegen. Die Anzahl der Elektronen werden mit der Anzahl der Valenzelektronen des Atoms verglichen.

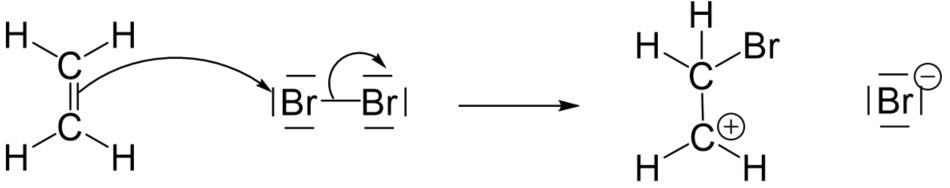
Die entstandene positive Ladung stellt ein Problem dar, da wiederholt ein Elektronenmangel entstanden ist und auch dieses Kohlenstoffatom nach ausreichend Elektronen strebt.
In diesem Fall steht nur noch das negativ geladene Bromion zur Verfügung, welches mit einem seiner freien Elektronenpaaren an der positiven Ladung angreifen kann.
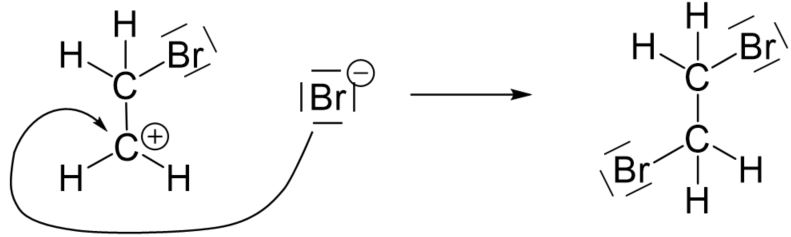
Da Bromatome im Vergleich zu Wasserstoffatomen relativ groß sind, wird sich das Bromion aus Platzgründen auf der gegenüberliegenden Seite des gebundenen Bromatoms anordnen. Diese Art von Angriff wird Rückseitenangriff genannt.
Neu!
„Addition“ heißt, dass ein Teilchen an ein Molekül angebaut wurde, ohne etwas aus dem Molekül „rauszuwerfen“, was in unserem Beispiel zutreffend ist. Die Bromatome aus dem Brommolekül wurden an das Ethenmolekül angebaut und alle Atome, die vorher in dem Molekül waren, sind weiterhin noch enthalten.
Elektrophil bedeutet, dass beim ersten Schritt ein Elektrophil an das Molekül gebaut wurde, also ein Teilchen, das einen Elektronenmangel hat. Das ist hier auch der Fall, da als erstes das positiv polarisierte Bromatom addiert wurde, an welchem durch den Angriff des Elektronenpaars der Elektronenmangel ausgeglichen wurde. m