Kohlenhydrate
Kohlenhydrate sind wichtige Nährstoffe. Sie sind neben den Fetten unsere wichtigsten Energielieferanten. Sie werden oft auch Zucker genannt. Welche verschiedenen Arten an Kohlenhydrate existieren und wie sie Aufgebaut sind, klären wir auf dieser Seite!
Neu!
Bei den Kohlenhydraten handelt es sich um organische Verbindungen aus Kohlenstoff, Wasserstoff und Sauerstoff. Sie können je nach Molekülbau unterschieden werden in Monosaccharide (Einfachzucker bestehend aus einem Zuckermolekül), Disaccharide (Zweifachzucker bestehend aus zwei Zuckermolekülen) und Polysaccharide (Mehrfachzucker bestehend aus mindestens zehn Zuckermolekülen).
Kohlenhydrate weisen spezielle Eigenschaften auf, welche in den folgenden Kapiteln beschrieben werden.
Inhaltsangabe auf dieser Seite:
- Optische Aktivität
- Molekülchiralität
- Fischerprojektion
- Stereoisomerie
- D- und L-Nomenklatur
- Glucose
- Haworth-Projektion
- Mutarotation
- Fructose
- Keto-Enol-Tautomerie
- Disaccharide
- Polysaccharide
Grundlagen Kohlenhydrate: Optische Aktivität
Kohlenhydrate sind sogenannte optisch aktive Substanzen, die linear polarisiertes Licht um einen bestimmten Winkel drehen. Was dies genau bedeutet, wird im Folgenden beschrieben:
Lichtwellen einer Lichtquelle verlaufen normalerweise in verschiedenen Schwingungsrichtungen. Wird Licht durch ein Polarisator gefiltert, werden alle Lichtwellen herausgefiltert, außer diejenigen, die senkrecht verlaufen. Die übriggebliebenen Lichtwellen verlaufen in der gleichen (senkrechten) Schwingungsrichtung. Bei ihnen handelt es sich um linear-polarisiertes Licht. Wird dieses nun durch ein Küvette geleitet, in dem eine optisch akive Substanz in Wasser gelöst ist, so wird die Schwingungsrichtung des linear polarisierten Lichts um einen bestimmten Winkel gedreht. Dieser Winkel, auch Drehwinkel genannt, kann mithilfe eines zweiten Polarisators gemessen werden.
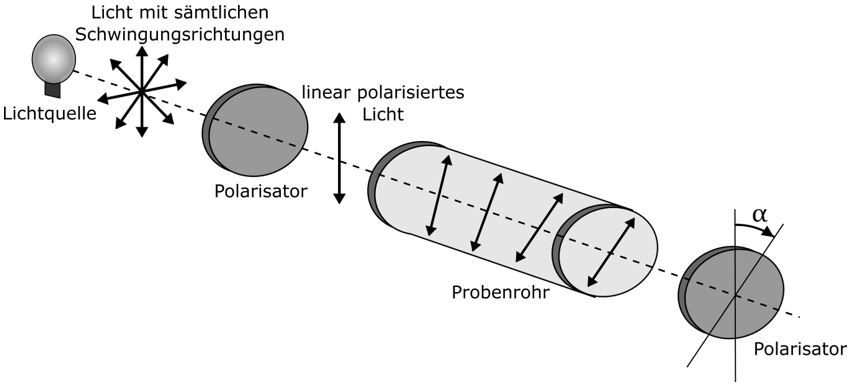
Auch Milchsäure ist eine optisch aktive Substanz. Jedoch existieren zwei verschiedene Sorten von Milchsäure: die rechts- und die linksdrehende Milchsäure.
Linksdrehend bedeutet, dass die Schwingungsrichtung gegen den Uhrzeigersinn ausgerichtet ist. Diese Moleküle werden mit einem (-) gekennzeichnet. Die linksdrehende Milchsäure wird auch (-)-Milchsäure genannt.
Rechtsdrehend bedeutet, dass die Schwingungsrichtung dem Uhrzeigersinn ausgerichtet ist. Diese Moleküle werden mit einem (+) gekennzeichnet. Die rechtsdrehende Milchsäure wird (+)-Milchsäure genannt. Es handelt sich bei den rechts- und linksdrehenden Molekülen um Enantiomere (Bild und Spiegelbild), weshalb sie auch unterschiedliche physikalische Eigenschaften aufweisen.
Molekülchiralität
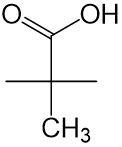
Wenn an einem Atom vier verschiedene Substituenten gebunden sind, handelt es sich um ein symmetrisches Atom. Dieses symmetrische Atom wird Chiralitätszentrum genannt. Diese werden mit einem Sternchen am asymmetrischen Atom gekennzeichnet.
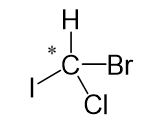
Um festzustellen, ob es sich um ein Chiralitätszentrum handelt, reicht es nicht aus die vier direkt an ein Atom gebundenen Atome zu betrachten. Bei dem folgenden Molekül sind beispielsweise an das mittlere Kohlenstoffatom zwei weitere Kohlenstoffatome gebunden. Es handelt sich trotzdem um ein Chiralitätszentrum, da sich die Atome, die an diese Kohlenstoffatome gebunden sind, voneinander unterscheiden. Unten ist eine -CH_3-Gruppe gebunden, oben eine -COOH-Gruppe. So sind vier verschiedene Gruppen an das mittlere Kohlenstoffatom gebunden und es handelt sich um ein Chiralitätszentrum.
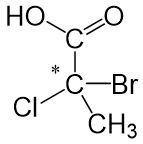
Moleküle mit mindestens einem Chiralitätszentrum sind, in der Regel, chiral, und somit optisch aktiv.
Fischerprojektion
Da bei Kohlenhydraten die räumliche Anordnung der Substituenten eine wichtige Rolle spielt, wäre es wichtig, eine räumliche Darstellung der Moleküle verwenden zukönnen. Diese sind bei großen Molekülen sehr unübersichtlich. Um die Kohlenhydrate übersichtlicher darzustellen wurde die Fischerprojektion entwickelt.
Um ein Molekül in der Fischerprojektion darzustellen, müssen folgende Regeln beachtet werden:
Neu!
- Die längste Kohlenstoffkette zeigt von oben nach unten. Dabei steht das endständige Kohlenstoffatom mit der höchsten Oxidationszahl oben.
- Das Molekül wird so gedreht, dass die Substituenten, an den asymmetrischen Kohlenstoffatomen nach hinten zeigen.
- Die Bindungen, die nach hinten zeigen, werden nun durch senkrechte Linien dargestellt. Alle Linien, die waagrecht sind, zeigen nach vorne.
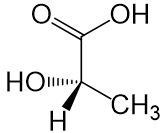
- Die längste Kohlenstoffkette soll von oben nach unten zeigen, wobei das endständige Kohlenstoffatom mit der höchsten Oxidationszahl oben stehen soll.
Zu Beginn bestimmen wir zunächst die Oxidationszahlen der beiden Kohlenstoffatome am Ende der Kette:
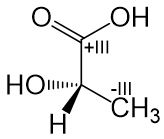
Das Kohlenstoffatom der Säuregruppe hat die höhere Oxidationszahl und steht daher oben. Daraus ergibt sich das folgende Grundgerüst für die Fischerprojektion:
- Im nächsten Schritt müssen die Substituenten eingezeichnet werden, in diesem Fall eine Hydroxygruppe und ein Wasserstoffatom.
Dazu wird das Molekül so gedreht, dass die Einfachbindungen zwischen den Kohlenstoffatomen nach hinten zeigen und die Substituenten nach vorne (wir schauen von links auf die oben dargestellte Form):
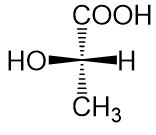
- Der Substituent, der jetzt nach rechts zeigt, wird in der Fischerprojektion auch rechts eingezeichnet. Der Substituent, der nach links zeigt, wird entsprechend links eingezeichnet. Alle Bindungen, die nach vorne zeigen, sind waagrecht eingezeichnet. Alle Bindungen, die nach hinten zeigen, sind senkrecht eingezeichnet.
Daraus ergibt sich dann folgende Fischerprojektion:
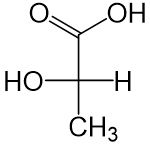
Stereoisomerie
Bei chiralen Molekülen spielt die räumliche Anordnung der Substituenten eine große Rolle. Ist die Verknüpfung der Atome in zwei Molekülen an einem Chiralitätszentrum unterschiedlich, so handelt es sich um Isomere.
In der Fischerprojektion wird die räumliche Anordnung der Substituenten an einem Chiralitätszentrum durch die Positionen rechts oder links symbolisiert. Werden die beiden Substituenten nun von rechts nach links und umgekehrt getauscht, ist diese räumliche Anordnung geändert. Wird die räumliche Anordnung an allen Chiralitätszentren geändert, so handelt es sich um Enantiomere (Bild und Spiegelbild). Die beiden Moleküle verhalten sich wie Bild und Spiegelbild. Wird die räumliche Anordnung nur an einem Teil der Chiralitätszentren geändert, handelt es sich um Diastereomere. Bei n Chiralitätszentren gibt es maximal 2^n Isomere.
Ändert man bei dem Molekül die räumliche Anordnung an allen Chiralitätszentren, tauscht also an allen die Substituenten von rechts nachlinks, so entsteht das Spiegelbild, also ein Enantiomer.

Wird die räumliche Anordnung nur an einem der beiden Chiralitätszentren geändert, so entstehen Diastereomere.
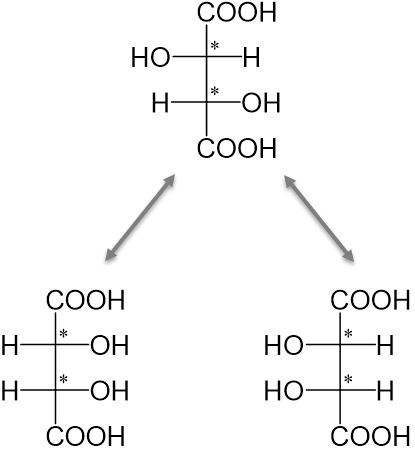
Diastereomer, das entsteht, wenn die räumliche Anordnung am oberen Chiralitätszentrum geändert wird.
Diastereomer, das entsteht, wenn die räumliche Anordnung am unteren Chiralitätszentrum geändert wird.
Bei der Weinsäure handelt es sich bei den Diastereomeren um eine besondere Form. Da beide Diastereomere identisch sind handelt es sich um eine meso-Verbindung. Es gibt trotz der beiden Chiralitätszentren nicht 2^2=4 Isomere, sondern nur 3. Diese meso-Verbindungen sind trotz ihrer Chiralitätszentren nicht optisch aktiv.
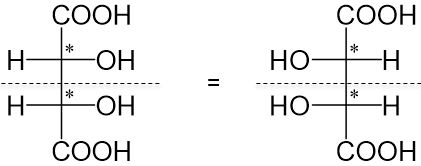
D- und L-Nomenklatur
Bei den Kohlenhydraten gibt es, wie bei der Weinsäure, immer zwei Isomere, die sich wie Bild und Spiegelbild verhalten (Enantiomere). Diese Enantiomere unterscheiden sich im Namen durch ein vorangestelltes D- oder L-. Die Bezeichnung wird von der Position der unteren Hydroxygruppe in der Fischerprojektion abgeleitet – steht die untere Hydroxygruppe rechts, so handelt es sich um die D-Form, steht sie links, handelt es sich um die L-Form. Als Beispiel betrachten wir die beiden Enantiomere der Weinsäure:

Da mit dieser Nomenklatur nur die Position der unteren Hydroxygruppe angegeben wird, müssen Diastereomere mit verschiedenen Namen angegeben werden (nur Enantiomere können den gleichen Namen mit dem Zusatz D oder L tragen).
ACHTUNG: Die D-/L-Nomenklatur hat nichts mit dem Drehwinkel zu tun!
Glucose
Glucose ist ein Monosaccharid, welches in der Natur ausschließlich als D-Glucose vorliegt (auch Traubenzucker genannt). Sie ist das häufigste Monosaccharid, das zu Kohlenhydraten gehört.
Die Summenformel von Glucose lautet C_6 H_12 O_6.
Die Position der Hydroxygruppen ist an den Chiralitätszentren sehr wichtig. Hierfür existiert eine einfach zu merkende Eselsbrücke: ta tü ta ta. Bei der D-Glucose sind die Hydroxygruppen bei ta auf der rechten Seite und bei tü auf der linken Seite. Bei der L-Glucose ist es genau umgekehrt.
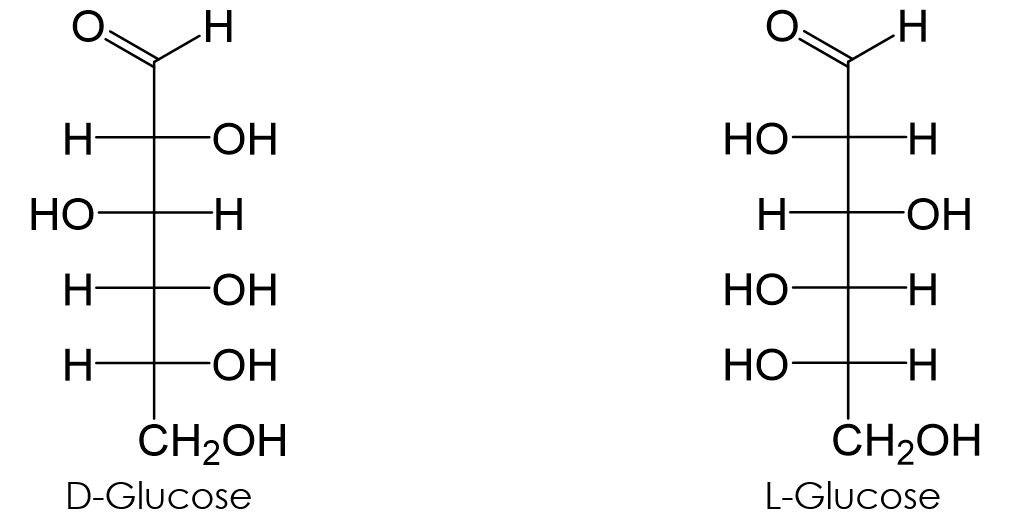
Da es sich bei der Glucose um einen Aldehyd handelt, kann man sie mit Hilfe der Silberspiegelprobe oder der Fehling-Probe nachweisen.
Glucose liegt in der Regel nicht in der oben dargestellten offenkettigen Form-, sondern in einer Ringform (Pyranosestruktur) vor, die durch eine nucleophile Addition zwischen der Hydroxygruppe des C5-Atoms und der Carbonylgruppe am C1-Atom gebildet wird. Der dabei entstehende Sechsring ist sehr stabil und wird Glucopyranose genannt.
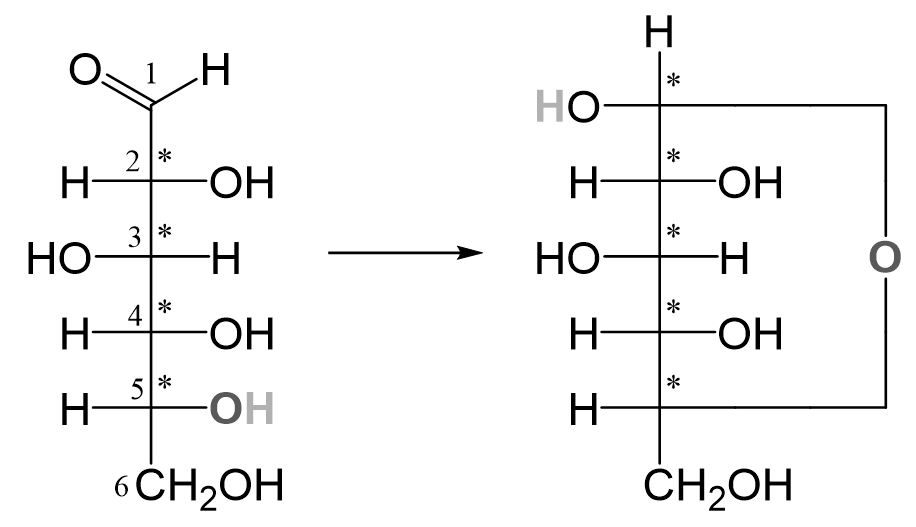
Durch den Ringschluss entsteht ein neues Chiralitätszentrum am C1-Atom.
Haworth-Projektion
Liegen Kohlenhydrate in der geschlossenen Ringform vor, so ist die Fischerprojektion keine geeignete Darstellungsform mehr, da hier die neuen Bindungen viel länger sind, als die anderen, obwohl sie in Wirklichkeit gleich lang sind. Daher wird für die Ringform der Kohlenhydrate eine andere Darstellungsform benötigt: die Haworth-Projektion. Um ein Kohlenhydratmolekül von der Fischerprojektion in die Haworth-Projektion umzuschreiben, müssen folgende Regeln beachtet werden:
- Das Molekül in der Fischerprojektion wird um 90° im Uhrzeigersinn gedreht, sodass die längste Kohlenstoffkette nicht mehr senkrecht, sondern waagrecht steht. Substituenten, welche in der Fischerprojektion auf der linken Seite stehen, stehen jetzt oben. Substituenten, welche in der Fischerprojektion rechts stehen, stehen jetzt unten.
- Die Kette wird so „gebogen“, dass ein gleichmäßiger Ring entsteht, wobei die Positionen der Substituenten (oben und unten) nicht verändert werden. Das Sauerstoffatom, welches Teil des Rings wird, wird dabei immer rechts oben platziert sein.
- Der Ring wird in einer nucleophilen Addition geschlossen.
- Das Molekül in der Fischerprojektion wird um 90° im Uhrzeigersinn gedreht.
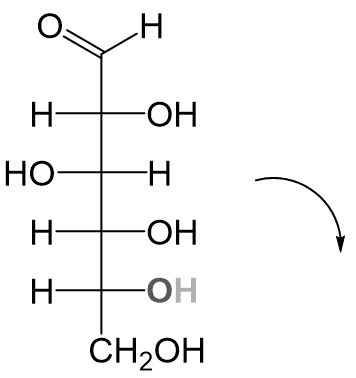
Substituenten, welche in der Fischerprojektion auf der linken Seite stehen, stehen jetzt oben, Substituenten, welche in der Fischerprojektion rechts stehen, stehen jetzt unten.
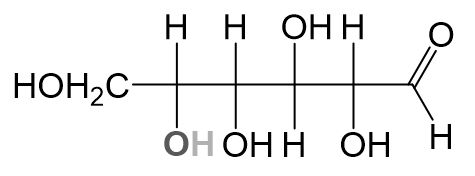
- Die Kette wird so gebogen, dass ein gleichmäßiger Ring entsteht, wobei die Positionen der Substituenten (oben und unten) nicht verändert werden). Das Sauerstoffatom, welches Teil des Rings wird, wird dabei immer rechts oben geschrieben.
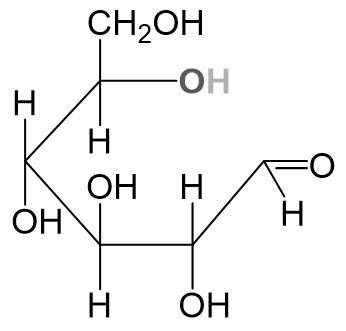
- Der Ring wird in einer nucleophilen Addition geschlossen.
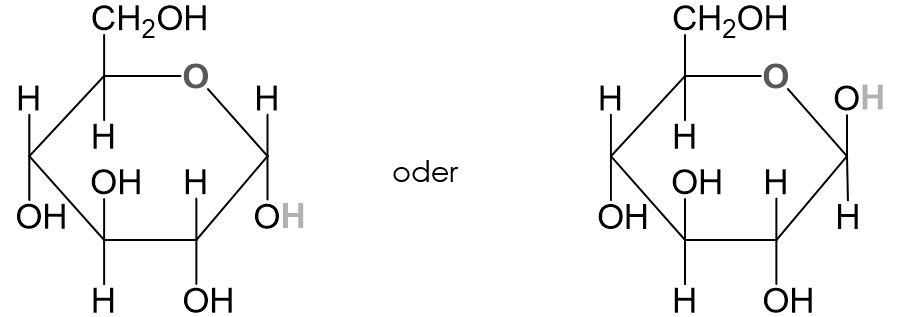
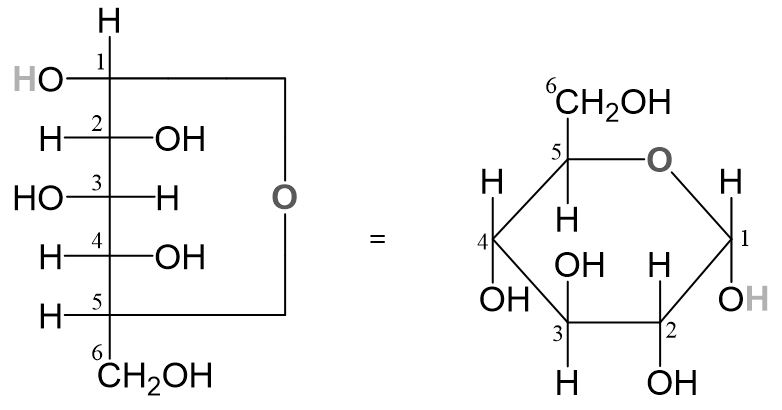
Hier die Fischerprojektion der ringförmigen Glucose im Vergleich zur Haworth-Projektion:
Mutarotation
Am C1-Atom entsteht durch den Ringschluss ein neues Chiralitätszentrum. Daher ist es hier jetzt auch wichtig, ob die Hydroxygruppe oben oder unten steht. Durch den Ringschluss können beide Formen gebildet werden.
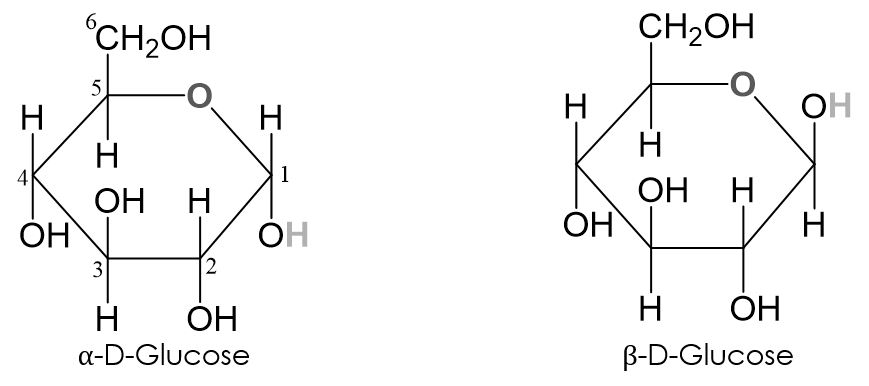
Steht die Hydroxygruppe unten am C1-Atom, handelt es sich um α-D-Glucose. Steht sie oben, handelt es sich um die β-D-Glucose. Diese beiden Formen sind sogenannte Anomere (Isomere, welche sich durch die räumliche Anordnung der Hydroxygruppe am C1-Atom im ringförmigen Zucker unterscheiden). Daher nennt man das neue Chiralitätszentrum auch anomeres Kohlenstoffatom.
In wässriger Lösung können die Formen „offenkettig“, „α-Form“ und „β-Form“ vorliegen. Indem die offenkettige Form zu einem der beiden Ringe geschlossen- und der Ring wieder aufgetrennt wird, werden sie wiederholend ineinander überführt. Es handelt sich bei diesen Reaktionen um Gleichgewichtsreaktionen, bei denen sich ein Gleichgewicht einstellt. Der Vorgang, durch den die beiden Anomere ineinander überführt werden, heißt Mutarotation.
Neu!
Fructose
Fructose ist ein weiteres wichtiges Monosaccharid. Die Summenformel von Fructose und Glucose (C_6 H_12 O_6) sind identisch, haben die beiden Konstitutionsisomere kaum Gemeinsamkeiten. Fructose ist kein Aldehyd, wie die Glucose, sondern ein Keton.
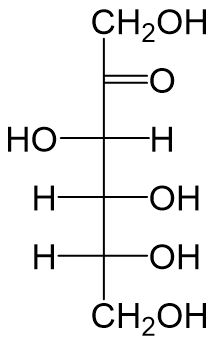
Fructose liegt, wie Glucose, meist ringförmig vor. Für den Ringschluss gibt es bei der Fructose zwei Möglichkeiten:
- Reaktion zwischen der Carbonylgruppe und der Hydroxygruppe am C5-Atom. Es entsteht ein Fünfring. Diese Form der Fructose nennt man Fructofuranose.
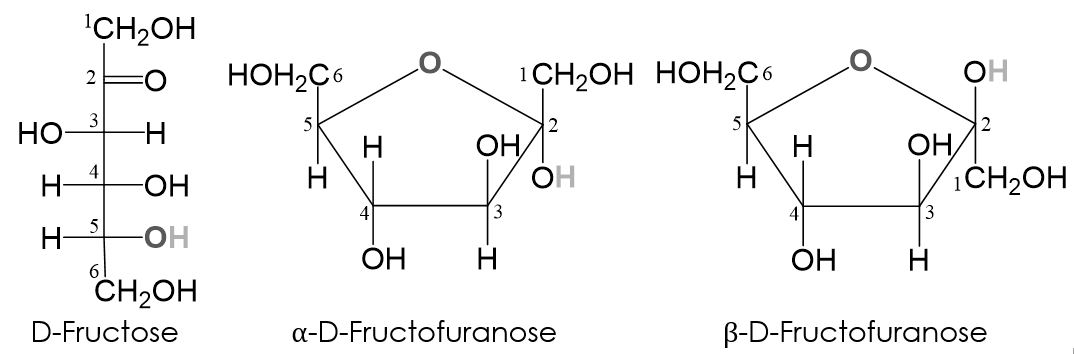
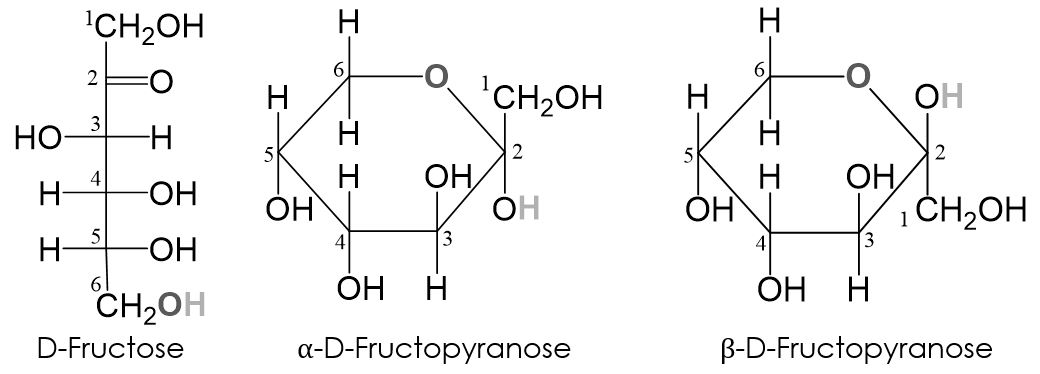
- Reaktion zwischen der Carbonylgruppe und der Hydroxygruppe am C6-Atom. Es entsteht ein Sechsring. Diese Form der Fructose nennt man Fructopyranose.
Keto-Enol-Tautomerie
Obwohl Fructose kein Aldehyd, sondern ein Keton ist, verlaufen die Silberspiegelprobe und die Fehling-Probe positiv. Doch wie kann das sein?
Für positive Silberspiegel- und Fehling-Proben muss in einem Molekül eine Aldehydgruppe vorkommen. Das heißt die Ketogruppe der Fructose muss in eine Aldehydgruppe umgewandelt werden. Diese Umwandlung heißt Keto-Enol-Tautomerie und verläuft folgendermaßen:
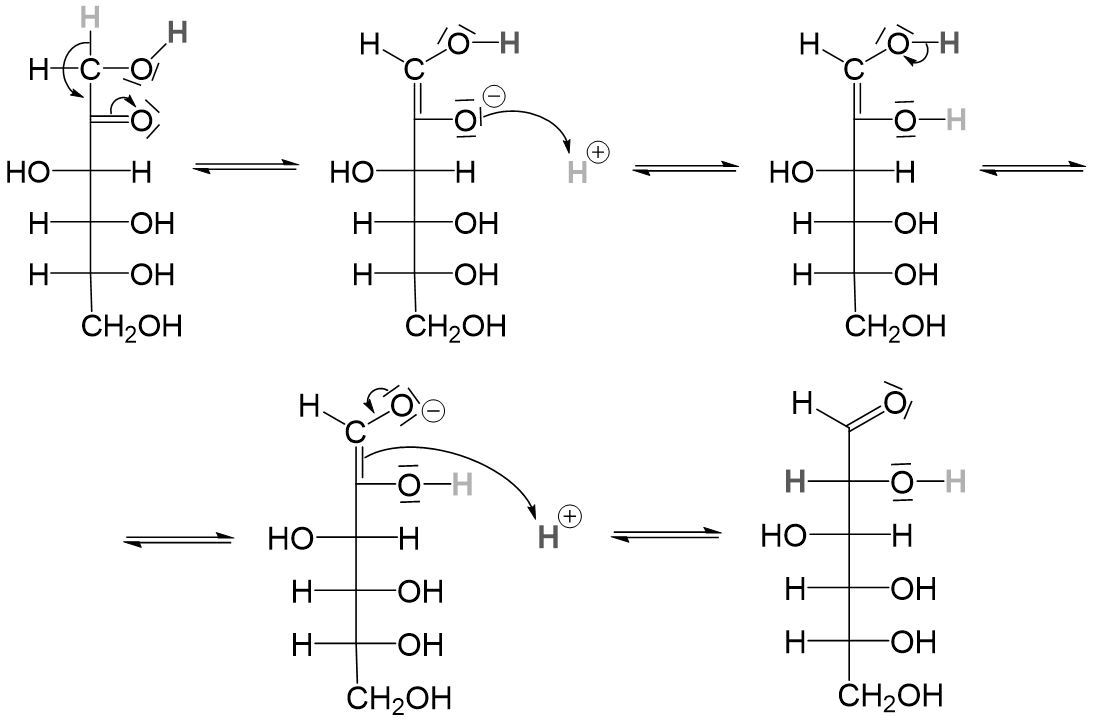
Im ersten Schritt wird vom C1-Atom ein Proton abgespalten, die Einfachbindung klappt rein und wird zur Doppelbindung, und daher muss die Doppelbindung zwischen dem Kohlenstoffatom und dem Sauerstoffatom rausklappen zum Sauerstoffatom. Durch die entstandene negative Ladung wird das positiv geladene Proton angezogen und aufgenommen. Anschließend wird an der oberen Hydroxygruppe ein Proton abgespalten, und es entsteht am Sauerstoffatom der Hydroxygruppe eine negative Ladung. Das Proton wird von dem Elektronenpaar der Doppelbindung angegriffen, wodurch das freie Elektronenpaar am oberen Sauerstoffatom nach innen klappen kann und zu einer Doppelbindung wird. So ist aus einem Keton ein Aldehyd entstanden.
Disaccharide
Disaccharide sind Kohlenhydrate, die sich aus zwei Monosacchariden zusammensetzen. Die beiden Monosaccharide sind über eine glycosidische Bindung miteinander verbunden. Bei der Bildung einer solchen glycosidischen Bindung reagieren zwei Hydroxygruppen in einer Kondensationsreaktion miteinander und bilden eine Sauerstoffbrücke.
Wir betrachten drei verschiedene wichtige Disaccharide, um das Prinzip der glycosidischen Bindung zu verdeutlichen:
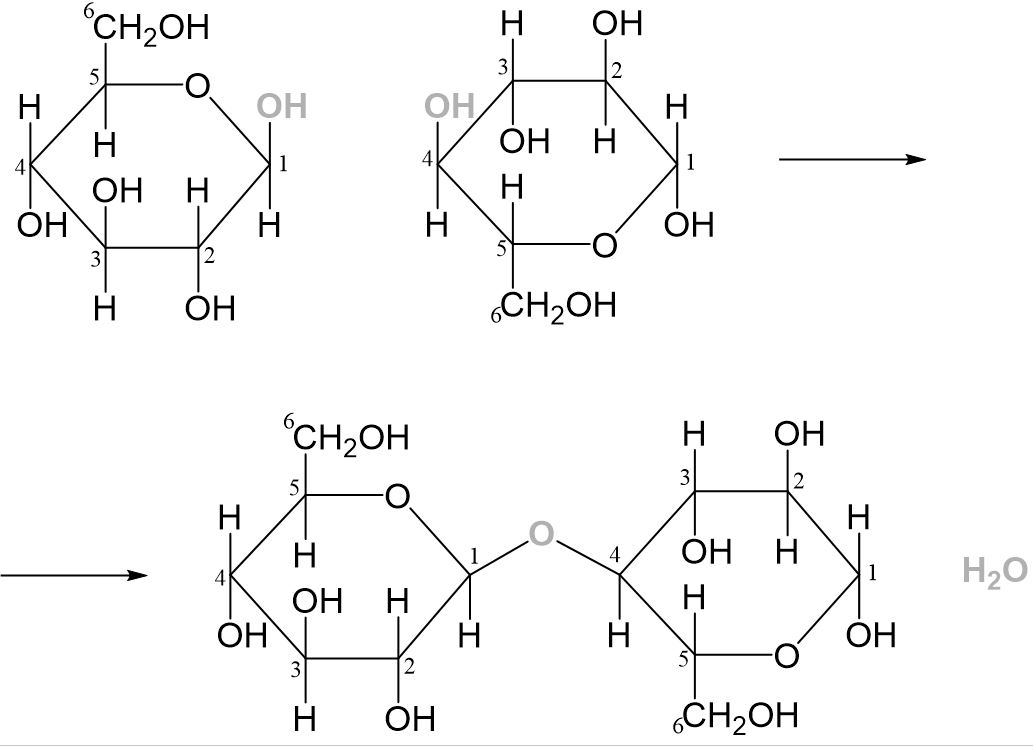
Maltose: Maltose ist ein Disaccharid mit einer α-1,4-glycosidischen Verbindung zwischen zwei α-Glucosemolekülen. Wir betrachten also zwei α-Glucosemoleküle. Es soll eine α-1,4-glycosidische Verbindung entstehen, das heißt die Hydroxygruppe am C1-Atom eines α-Glucosemoleküls reagiert mit der Hydroxygruppe am C4-Atom eines anderen α-Glucosemoleküls. Dabei tritt ein Wassermolekül aus.
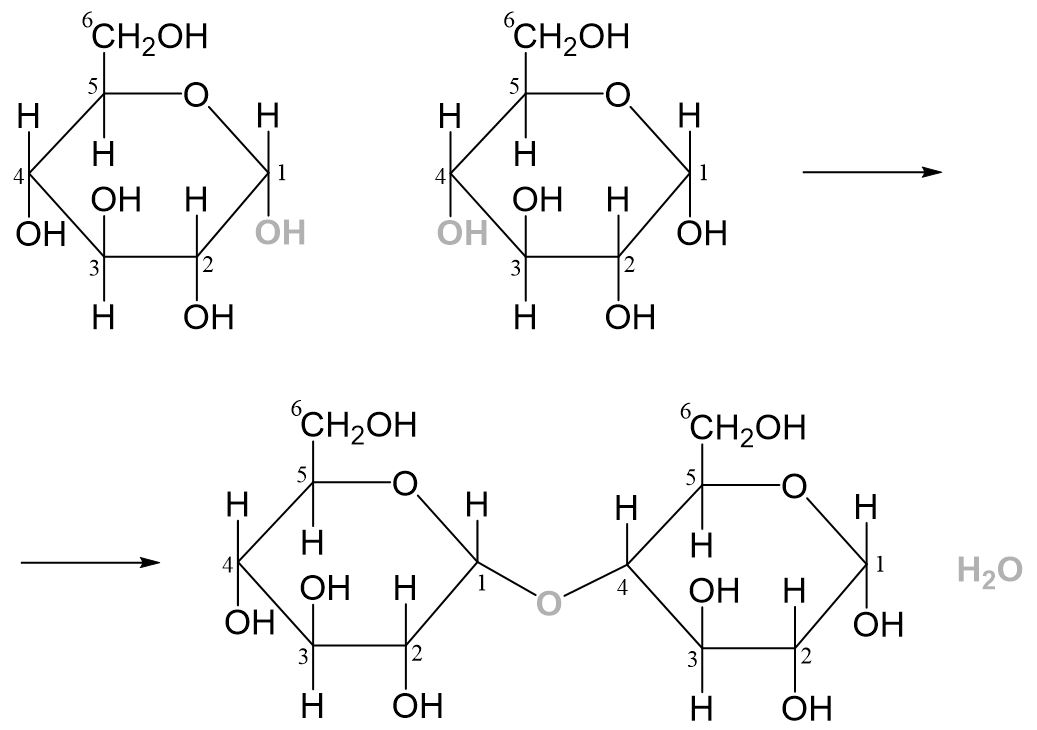
Cellobiose ist ein Disaccharid mit einer β-1,4-glycosidischen Verbindung zwischen β-Glucose und α-Glucose. Wir betrachten also ein α- und ein β-Glucosemolekül. Es soll eine β-1,4-glycosidische Verbindung entstehen, das heißt die Hydroxygruppe am C1-Atom eines β-Glucosemoleküls reagiert mit der Hydroxygruppe am C4-Atom eines anderen α-Glucosemoleküls. Dabei tritt ein Wassermolekül aus.
Damit die beiden Hydroxygruppen miteinander reagieren können, müssen beide entweder nach oben oder nach unten ausgereichtet sein. In diesem Fall steh aber eine nach oben und eine nach unten. Da die räumliche Anordnung nicht einfach geändert werden kann, müssen wir das gesamte Molekül umdrehen (an der eingezeichneten Spiegelebene spiegeln).
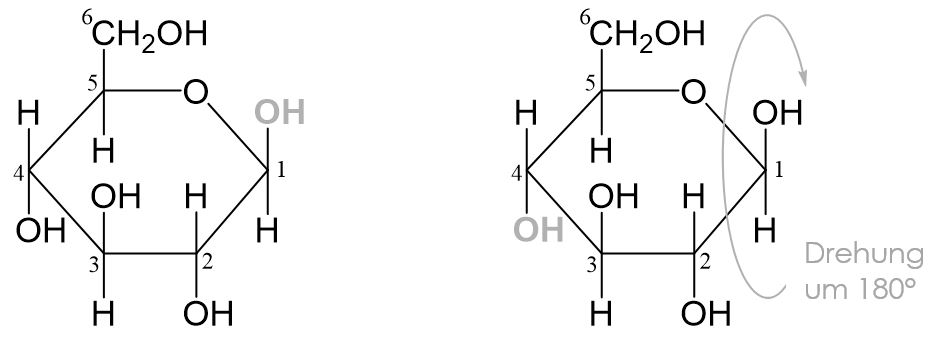
Sobald eines der beiden Moleküle gedreht wurde stehen die beiden Hydroxygruppen beide nach oben und sie können miteinander reagieren.
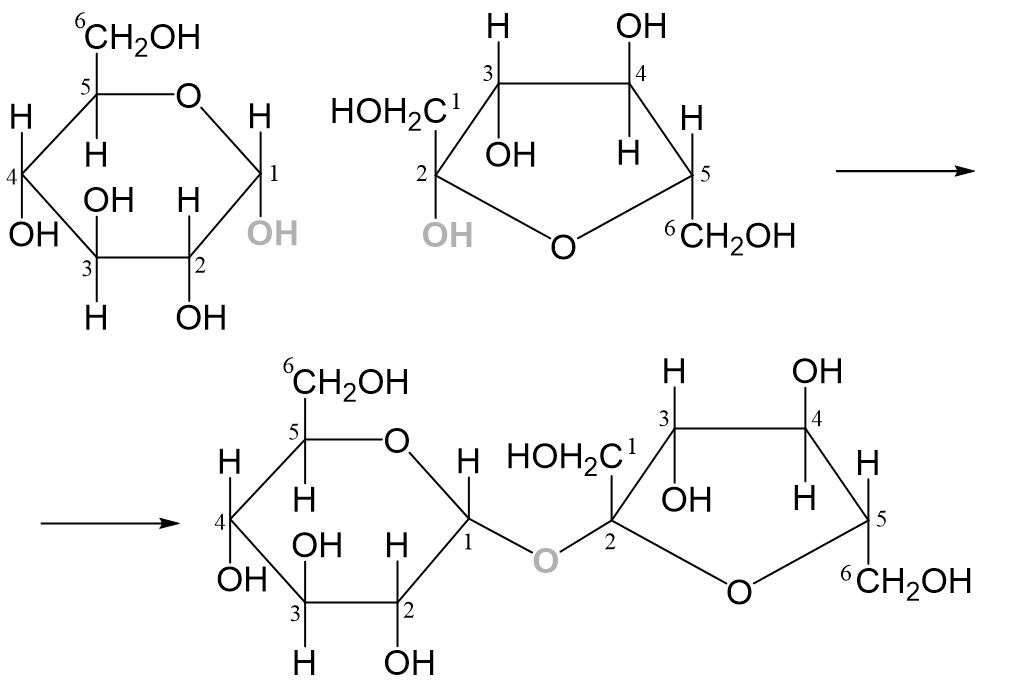
Saccharose: Saccharose ist ein Disaccharid mit einer α-1,2-glycosidischen Verbindung zwischen α-Glucose und β-Fructose. Wir betrachten also ein α-Glukose- und ein β-Fructosemolekül. Es soll eine α-1,2-glycosidische Verbindung entstehen, das heißt die Hydroxygruppe am C1-Atom eines α-Glucosemoleküls reagiert mit der Hydroxygruppe am C2-Atom eines β-Fructosemoleküls. Dabei tritt ein Wassermolekül aus.
Damit die beiden Hydroxygruppen miteinander reagieren können, müssen sie wieder gleichgerichtet sein. Wir müssen das Molekül also so drehen, dass das C2-Atom der Fructose neben dem C1-Atom der Glucose ist und dass beide Hydroxygruppen nach unten ausgerichtet sind.
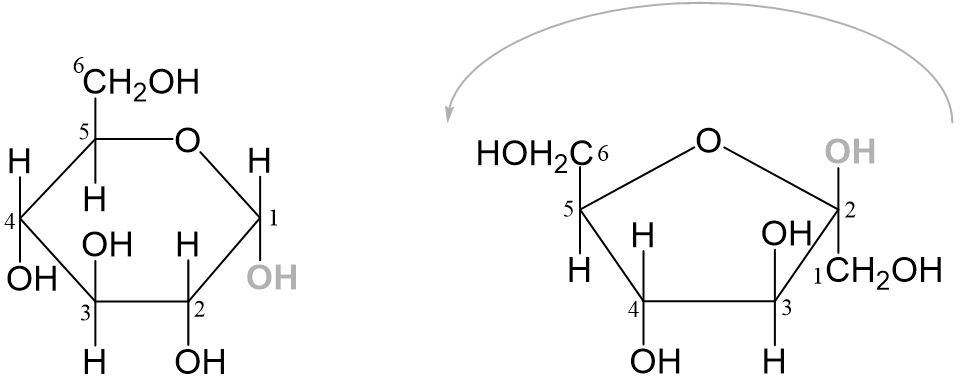
Jetzt sind die beiden Hydroxygruppen nebeneinander und können miteinander reagieren.
Disaccharide, bei denen die Hydroxydgruppe am anomeren Kohlenstoffatom eines der beiden Monosaccharide nicht an der Bildung der glycosidischen Bildung beteiligt ist, verlaufen in einer positiven Silberspiegelprobe oder Fehling-Probe. Ein Monosaccharid, dessen Hydroxygruppe am anomeren Kohlenstoffatom erhalten bleibt, kann durch Mutarotation von der Ringform in die offenkettige Form übergehen. In der offenkettigen Form ist die Aldehydgruppe vorhanden, welche eine positive Silberspiegel- oder Fehling-Probe aufweist. Maltose und Cellobiose gehören zu diesen Disacchariden.
Disaccharide, bei denen die glycosidische Bindung durch die Reaktion zwischen den Hydroxygruppen an den beiden anomeren Kohlenstoffatomen entsteht, kann keines der beiden Monosaccharide in die offenkettige Form überführt werden, weshalb das Molekül zu keiner Zeit eine freie Aldehydgruppe hat. Daher verlaufen die Silberspiegel- und die Fehlingprobe bei solchen Disacchariden negativ. Saccharose gehört zu diesen Disacchariden.
Polysaccharide
Polysaccharide sind Kohlenhydrate, welche sich aus mindestens zehn Monosacchariden über glycosidische Bindungen zusammensetzen.
Ein wichtiges Polysaccharid ist Stärke. Es handelt sich um einen wichtigen pflanzlichen Speicherstoff und besteht aus zwei Bestandteilen: Amylose und Amylopektin.
Amylose macht ca. 20 % der Stärke aus. Es handelt sich um ein Polysaccharid, das aus Glucosemolekülen mit α-1,4-gylkosidischen Bindungen besteht.
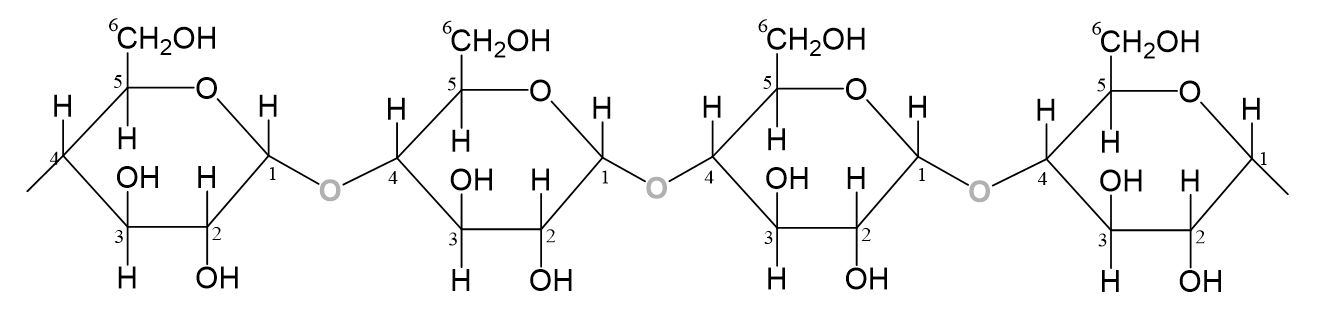
Das Makromolekül ist allerdings nicht linear gebaut, sondern spiralförmig.
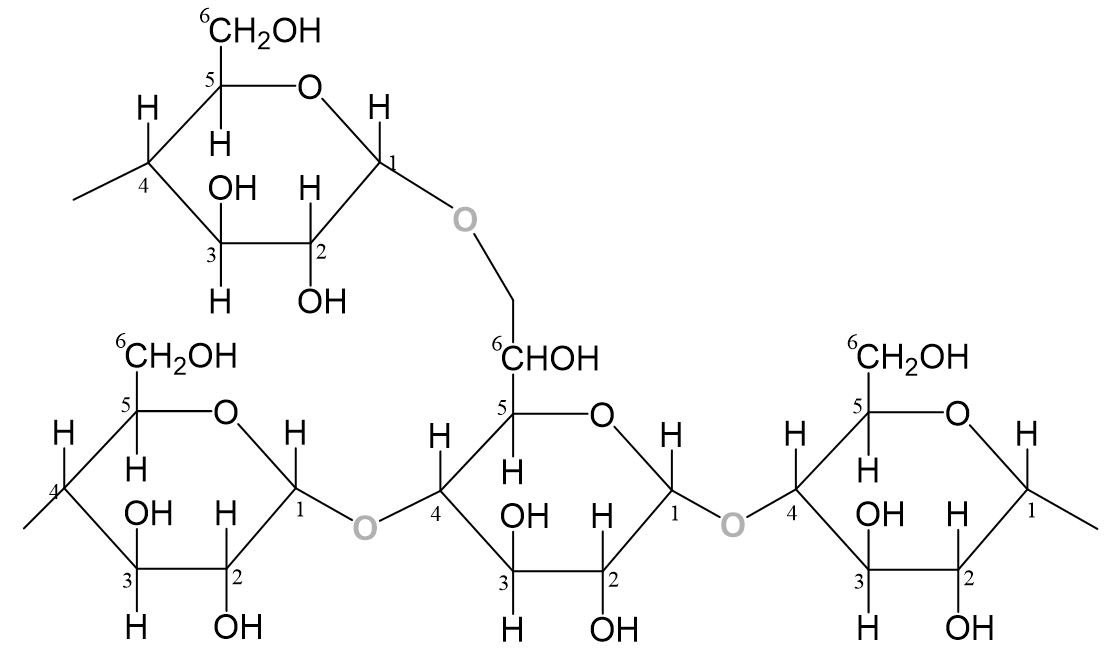
Amylopektin macht ca. 80 % der Stärke aus. Es handelt sich um ein Polysaccharid, welches zusätzlich zu den α-1,4-gylkosidischen Bindungen zwischen den Glucosemolekülen noch α-1,6-glycosidische Bindungen ausbildet, wodurch das Makromolekül verzweigter ist.
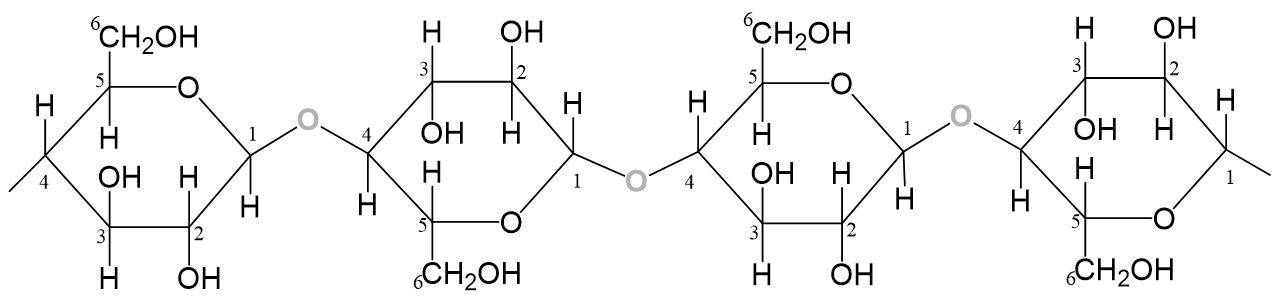
Ein weiteres wichtiges Polysaccharid ist die Cellulose, ein pflanzlicher Baustoff. Es handelt sich um ein Makromolekül, welches sich aus β-Glucosemolekülen mit β-1,4-glycosidischen Bindungen zusammensetzt. Das Cellulose-Makromolekül ist linear gebaut, weshalb sich die typische faserartige Struktur ergibt.
Neu!