Fette
Inhalt auf dieser Seite
- Struktur von Fetten
- Herstellung von Fetten
- Eigenschaften von Fetten
- Schmelzbereich
- Löslichkeit und Dichte von Fetten
- Bedeutung von Fetten für den Menschen
Neu!
Struktur von Fetten
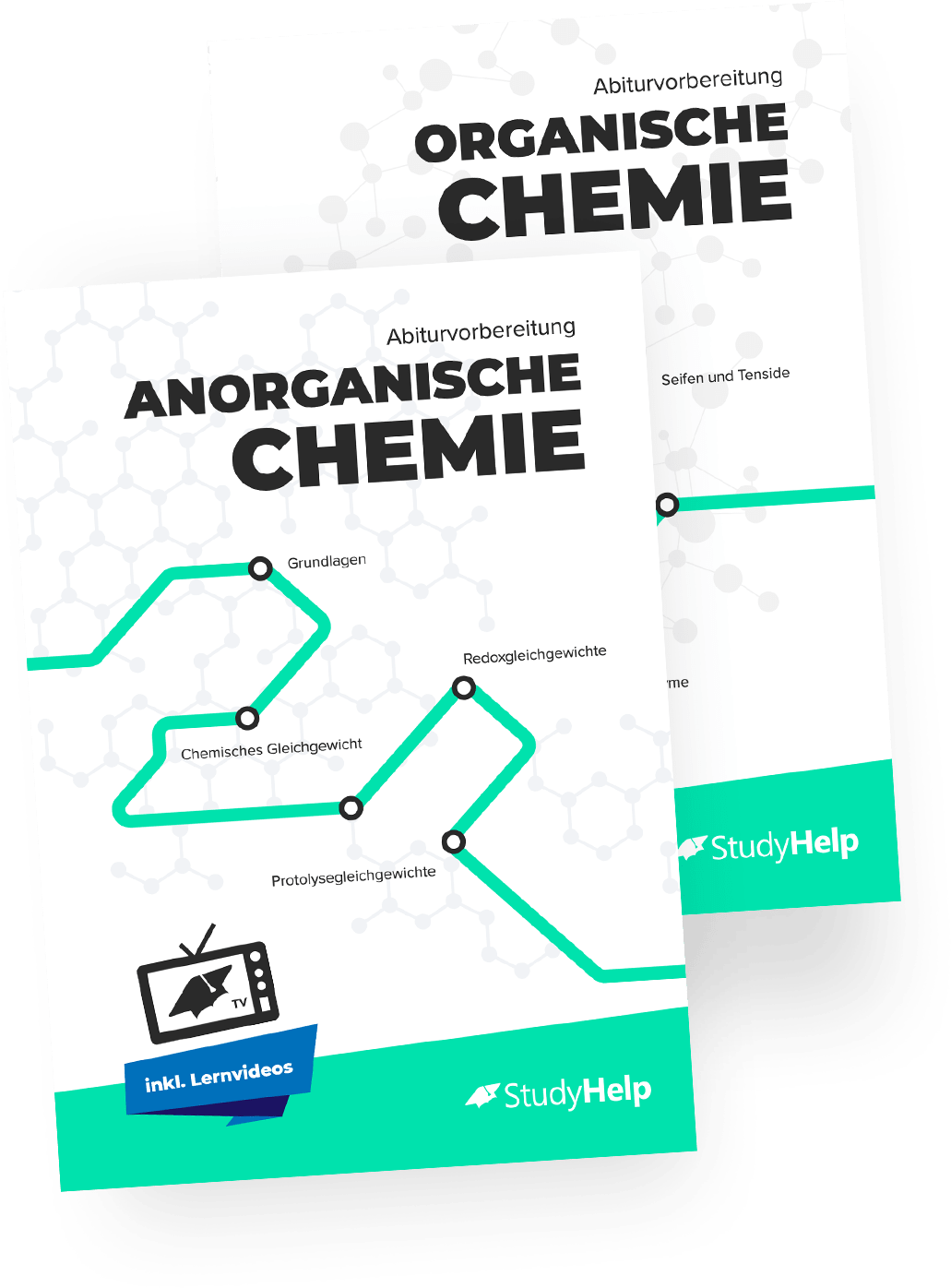
Fette, auch Lipide genannt, sind sogenannte Triacylglycerine. Das sind Moleküle, die durch Veresterung aller Hydroxygruppen des Glycerinmoleküls (Propan-1,2,3-triol) entstehen. Die dafür benötigten Carbonsäuren nennt man Fettsäuren.
Fette können bei Raumtemperatur entweder fest oder flüssig sein. Die festen Triacylglycerine werden Fette genannt, die flüssigen fette Öle (sie unterscheiden sich von ätherischen Ölen und Mineralölen). Der Aggregatzustand ist abhängig von den in den Fetten gebundenen Fettsäuren.
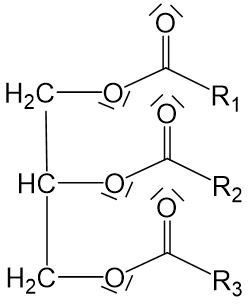
Fettsäuren sind langkettige, unverzweigte Carbonsäuren mit einer geraden Anzahl an Kohlenstoffatomen. Es gibt gesättigte Fettsäuren ohne Mehrfachbindungen und ungesättigte Fettsäuren mit nichtkonjugierten Doppelbindungen in Z-Konfiguration.
In der Tabelle findest du eine Auswahl einiger wichtiger Fettsäuren:
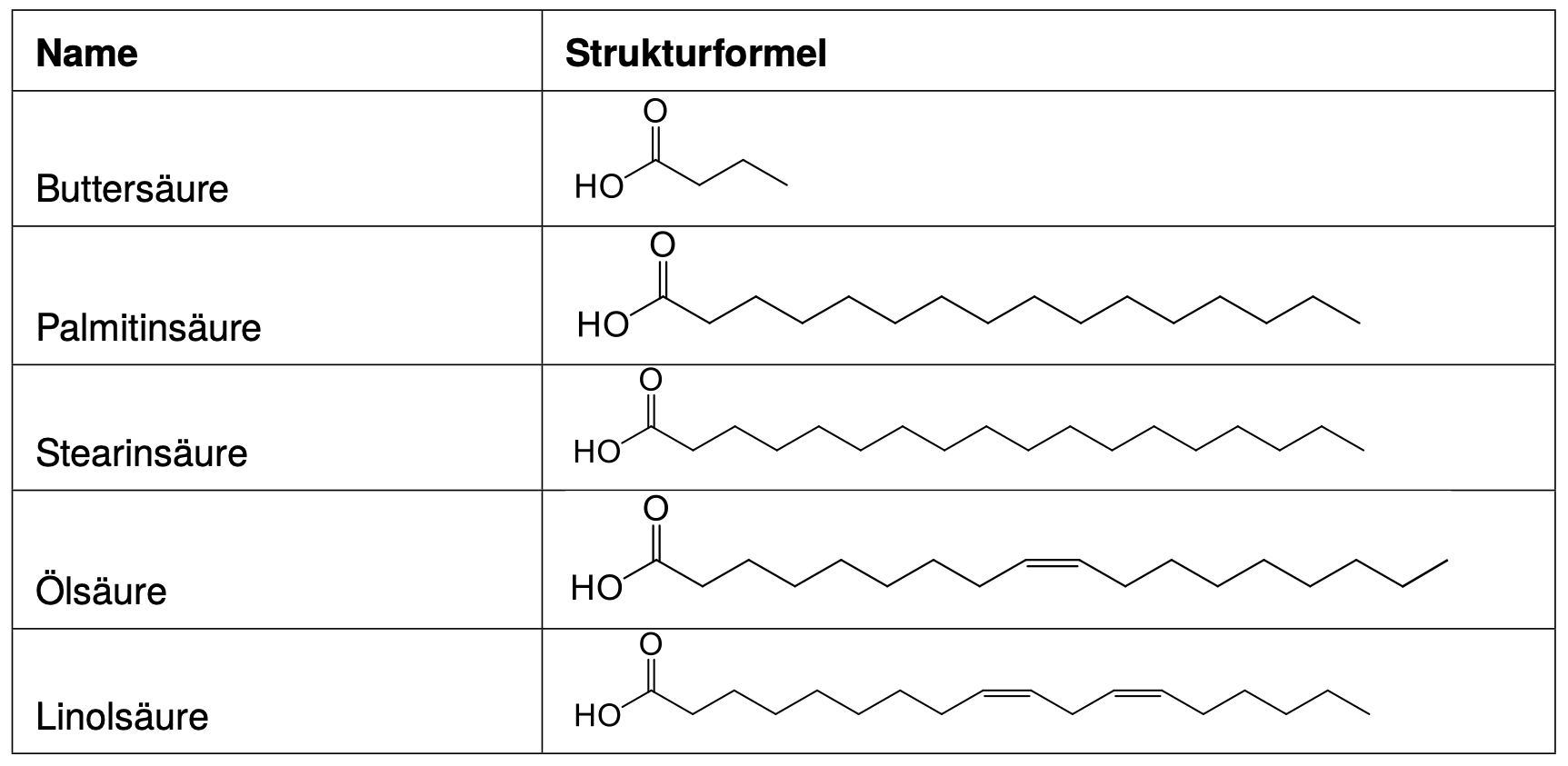
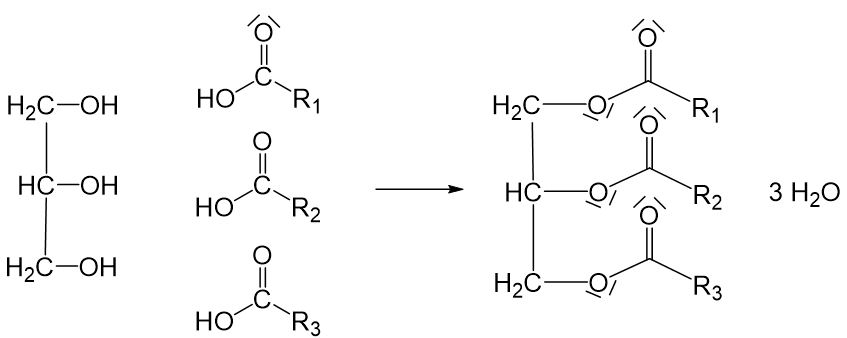
Herstellung von Fetten
Fette werden in einer Veresterung mit Glycerin und drei Fettsäuren hergestellt. Dabei können die Fette nur eine Sorte oder auch unterschiedliche Fettsäuren enthalten. (Mechanismus siehe Kapitel 4.5 Kondensationsreaktion)
Eigenschaften von Fetten
Schmelzbereich
Erhitz man Fette werden sie langsam weich und schmelzen dann allmählich. Es gibt also keinen exakten Schmelzpunkt, sondern einen Schmelzbereich. Das liegt daran, dass Fette meist keine Reinstoffe sind, sondern ein Gemisch aus verschiedenen Triacylglycerinen mit jeweils unterschiedlichen Schmelzpunkten.
Ob es sich bei einem Triacylglycerin nun um ein festes Fett oder ein fettes Öl handelt, hängt davon ab, welche Fettsäuren in dem Molekül gebunden sind. Bei festen Fetten sind die zwischenmolekularen Wechselwirkungen höher als bei den fetten Ölen. Die einzigen Wechselwirkungen die hier auftreten können, sind van-der-Waals-Wechselwirkungen. Es gelten also wieder die bereits bekannten Entscheidungsregeln, was hier im speziellen folgendes bedeutet:
- Je länger die Fettsäure ist, desto höher sind die van-der-Waals-Kräfte.
- Je mehr Doppelbindungen in der Fettsäure sind, desto niedriger sind die van-der-Waals-Kräfte, da durch Doppelbindungen Knicke entstehen, und das Fettmolekül somit sperriger wird.
Sind also lange gesättigte Fettsäuren in dem Fettmolekül gebunden, handelt es sich um ein festes Fett. Sind hingegen Fettsäuren mit vielen Doppelbindungen gebunden, handelt es sich um ein fettes Öl.
Neu!
Löslichkeit und Dichte von Fetten
Fette lassen sich nicht in Wasser lösen, da sie unpolar sind. Das liegt an den langen unpolaren Ketten der Fettsäuren.
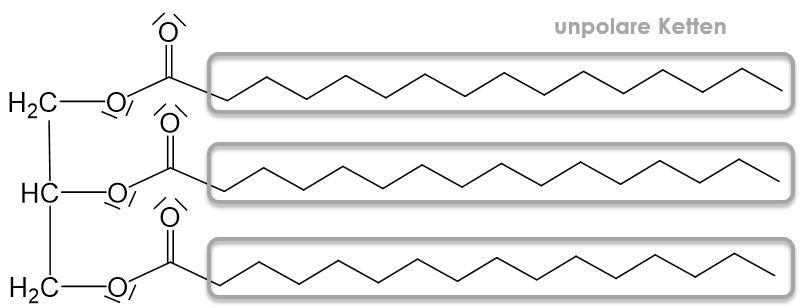
Da Fette immer auf dem Wasser schwimmen, muss die Dichte von Fetten geringer sein als die von Wasser. Um diesen Zusammenhang zu erklären müssen wir uns auch wieder die Molekülstruktur anschauen. Die einzigen zwischenmolekularen Wechselwirkungen die zwischen Fettmolekülen auftreten sind, van-der-Waals-Kräfte. Wassermoleküle können hingegen die sehr starken Wasserstoffbrückenbindungen ausbilden. Die zwischenmolekularen Wechselwirkungen des Wassers sind also deutlich stärker als die der Fettmoleküle, wodurch die Wassermoleküle sich gegenseitig stärker anziehen und somit auch näher zusammen sind. Das wiederum bedeutet, dass die Dichte des Wassers höher ist als die von Fetten.
Bedeutung von Fetten für den Menschen
Fette sind für den Menschen sehr wichtig, da sie unter anderem als Energiequelle dienen. Daher nutzt der Körper Fette auch zur langfristigen Speicherung von Energie.
Des Weiteren sind ungesättigte Fettsäuren wichtig für das Wachstum, den Aufbau von Zellmembranen, etc. Sie können jedoch vom Körper nicht selbst hergestellt werden, was bedeutet, dass diese Fettsäuren essenziell sind. Daher müssen die entsprechenden Fette aufgenommen werden, welche dann zersetzt werden können in die jeweiligen ungesättigten Fettsäuren.
Der Konsum von Fetten wird besonders dann wichtig, wenn wir Nahrung zu uns nehmen, die die Vitamine A, D oder E enthält. Dabei handelt es sich nämlich um fettlösliche Vitamine. Werden diese ohne Fette konsumiert, können sie nicht vom Körper aufgenommen werden und werden unverdaut ausgeschieden.
Da Fette energiereich sind, können sie auch als Treibstoff eingesetzt. Wenn die Fette dafür aus Pflanzen (meist Raps) gewonnen, handelt es sich um nachwachsende Rohstoffe. Rapsöl selbst ist für Motoren allerdings zu dickflüssig. Daher wird es in einer chemischen Reaktion zu Biodiesel umgewandelt. Rapsöl wird dafür mit Methanol zur Reaktion gebracht, wobei der Biodiesel und Glycerin entstehen. Diese Art von Reaktion nennt man Umesterung.
Bei dieser Reaktion handelt es sich um eine nucleophile Substitution, bei der zunächst das freie Elektronenpaar der Hydroxygruppe an dem positiv polarisierten Kohlenstoffatom des Esters angreift.
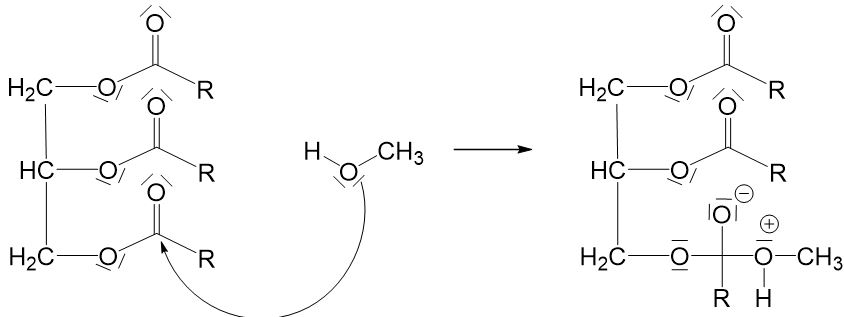
Die dabei entstandene positive Ladung am Sauerstoffatom muss ausgeglichen werden. Im ersten Moment scheint es naheliegend, dass diese ausgeglichen werden kann, indem ein Proton abgespalten und durch ein freies Elektronenpaar am negativ geladenen Sauerstoffatom aufgenommen wird. Dann wären alle Ladungen ausgeglichen. Doch hier kommt jetzt zum ersten Mal ein weiteres Grundprinzip ins Spiel: Es können maximal zwei Sauerstoffatome an einem Kohlenstoffatom gebunden sein. Also müssen wir hier eine der Einfachbindungen zwischen dem Kohlenstoffatom und einem Sauerstoffatom aufbrechen. Die einzige, die hier in Frage kommt, ist die Einfachbindung zwischen dem Kohlenstoffatom und dem Sauerstoffatom links daneben (würden wir die rechts daneben aufbrechen, würden wir wieder am Anfang ankommen, und würden wir die obere aufbrechen, würde ein sehr instabiles O^(2-)-Ion entstehen). Damit diese Einfachbindung leichter aufgebrochen werden kann, findet zunächst eine Umlagerung des Protons vom rechten Sauerstoffatom zum linken statt. Durch die entstehende positive Ladung möchte das Sauerstoffatom die Einfachbindung dann nicht mehr so gerne teilen und sie kann leichter aufgebrochen werden.
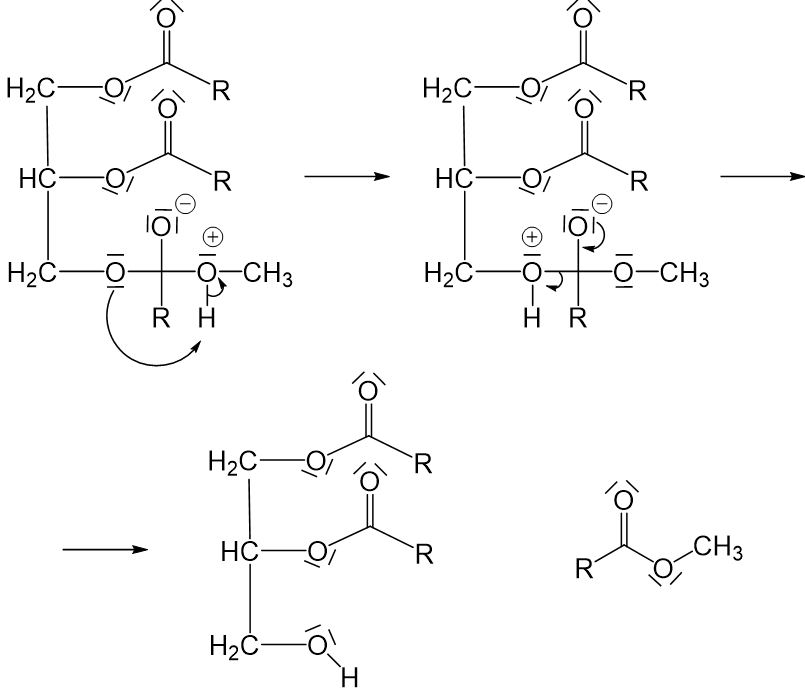
Diese Reaktion findet an allen drei Estergruppen statt, wodurch aus einem Rapsölmolekül drei Biosdieselmoleküle entstehen.
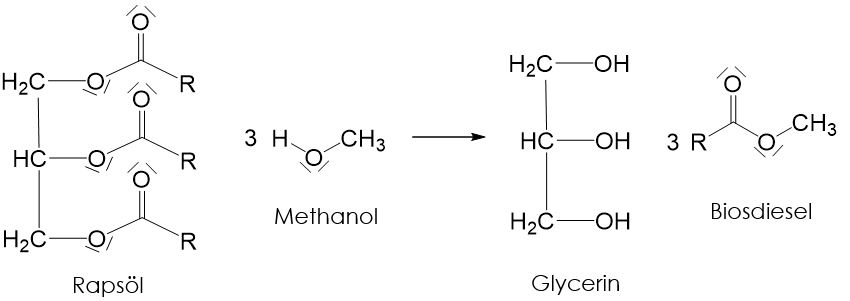
Der Vorteil von Biodiesel ist, dass das bei der Verbrennung entstehende Kohlenstoffdioxid genau der Menge entspricht, die bei der Fotosynthese des Raps benötigt wird. Die CO_2-Bilanz ist allerdings nicht so perfekt, wie es auf den ersten Blick scheint, da für die Herstellung von Biodiesel Energie benötigt wird, wodurch auch Kohlenstoffdioxid entsteht. Leider gibt es noch weitere Nachteile des Biodiesels: beim Wachstum der Rapspflanze entsteht nämlich noch ein anderes Treibhausgas (Lachgas), welches den Treibhauseffekt noch mehr verstärkt als Kohlenstoffdioxid. Und selbst wenn wir gerne die gesamte Energie aus nachwachsenden Rohstoffen gewinnen würden, reicht die Agrarfläche nicht mal annähernd aus, um so viele Pflanzen zu züchten, dass uns die Energie ausreicht.
Neu!