Mesomerie
Was ist Mesomerie?
Der Begriff Mesomerie beschreibt das Phänomen, bei dem Bindungsverhältnisse von manchen Molekülen nicht durch eine einzige Strukturformel dargestellt werden können.
Eine einzige Strukturformel reicht nicht aus, da der Zustand mancher Moleküls nicht starr ist, sondern sich ständig anpasst. Diese Anpassung erfolgt durch äußerlichen Einflüssen. So können sich Elektronen in einem Molekül verschieben. Durch diese Verschiebung verändern sich auch die Bindungsverhältnisse. Diese sich ändernden Bindungsverhältnisse werden durch Grenzstrukturen dargestellt, die den Zustand des Moleküls versuchen zu beschreiben.
Wichtig: Durch die ständige Veränderung des Moleküls befindet sich dessen Zustand in der Realität zwischen den Grenzstrukturen und kann nicht klar erfasst werden.
Es gilt auch: Je mehr mesomere Grenzstrukturen es zu einem Molekül gibt, desto stabiler ist es.
Die Elektronen dieser Moleküle sind delokalisiert. Dies bedeutet, dass sie nicht einem bestimmten Atom zugeordnet werden können, sondern sich bewegen.
Die einzelnen Grenzstrukturen werden mit einem sogenannten Mesomerie-Pfeil ↔ symbolisiert (diesen bitte nicht mit einem Gleichgewichtspfeil verwechseln).
Möchte man nun die verschiedenen Grenzstrukturen eines Moleküls aufstellen, so muss man diese Regeln befolgen:
- Elektronenpaare – entweder freie Elektronenpaare oder Elektronenpaare aus Doppelbindungen – werden umgeklappt.
- Elektronenpaare können immer nur zum Nachbaratom geklappt werden und nicht über zwei Atome hinweg.
- Sind an dem Atom, zu dem das Elektronenpaar geklappt wurde nun zu viele Elektronen, so muss hier ein Elektronenpaar weggeklappt werden. Wenn das nicht geht, ist diese Grenzstruktur nicht möglich.
Am Besten schauen wir uns das an einem Beispiel an!
Zur weiteren Vertiefung schau dir das Lernvideo zum Thema Mesomerie von Die Merkhilfe an!
Mesomerie Beispiel: Benzol
Das folgende Beispiel kann auf den ersten Blick unverständlich wirken. Nehmt euch die nötige Zeit um es nachzuvollziehen!
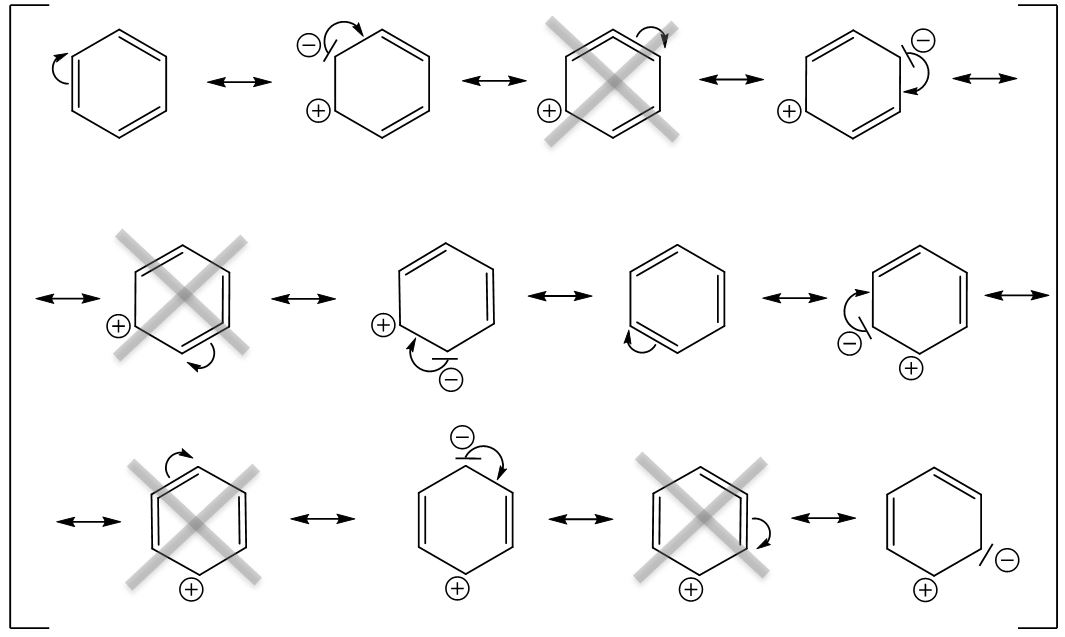
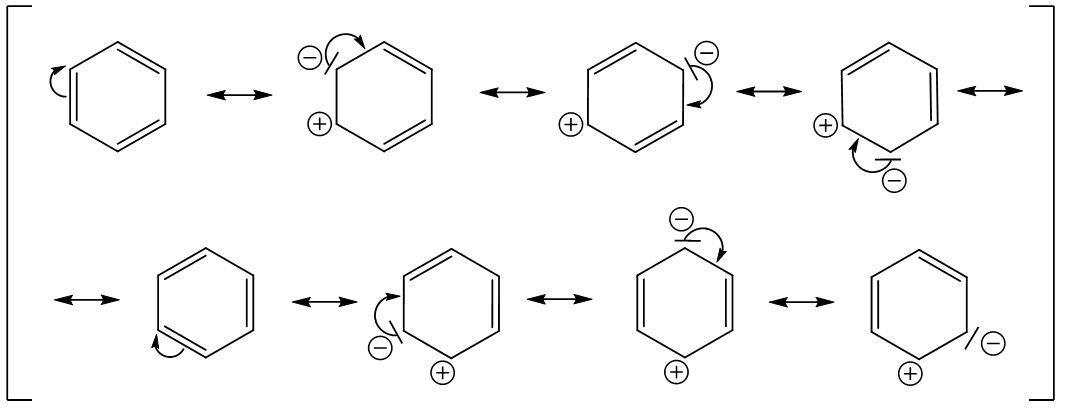
Wird das erste Elektronenpaar (hier aus einer Doppelbindung) zum Nachbaratom geklappt, so wird aus der Doppelbindung ein freies Elektronenpaar am Kohlenstoffatom.
Klappen wir dieses Elektronenpaar nun eine Position weiter, so bekommen wir am oberen Kohlenstoffatom ein Problem (Grenzstruktur 3), da fünf Bindungen am Kohlenstoffatom sind, jedoch nur vier möglich wären (hier nicht vergessen, dass an jedem Kohlenstoffatom noch ein Wasserstoffatom gebunden ist).
Neu!
Also müssen wir hier das Elektronenpaar der Doppelbindung weiterklappen. Hierbei entsteht wieder ein freies Elektronenpaar an einem Kohlenstoffatom. Dieses Verfahren wird so lange wiederholt, bis wir wieder bei der ursprünglichen Grenzstruktur ankommen. In diesem Fall entstehen dann acht mögliche Grenzstrukturformeln.
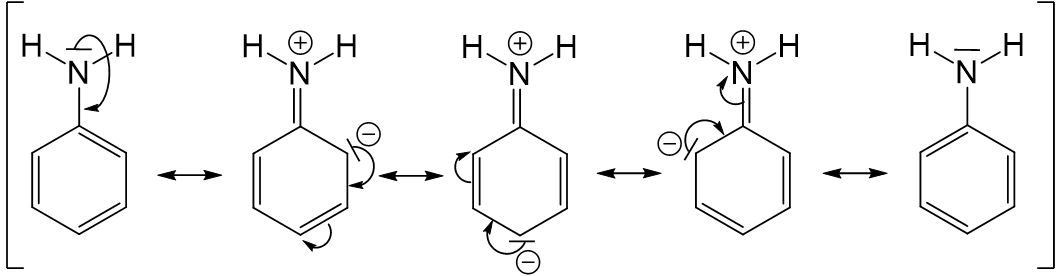
Mesomerie Beispiel: Anilin