Säure-Base-Indikatoren
Neu!
Säure-Base-Indikatoren sind meistens organische Farbstoffe. Ein Beispiel für einen dieser Farbstoffe ist Phenolphthalein. Dieser Indikator ist in saurem Milieu farblos- in basischem pink. Um diese Farbunterschiede zu erklären, betrachten wir die entsprechenden Strukturformeln.
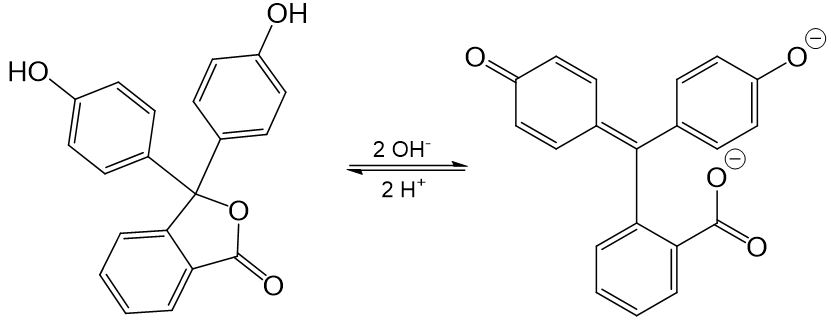
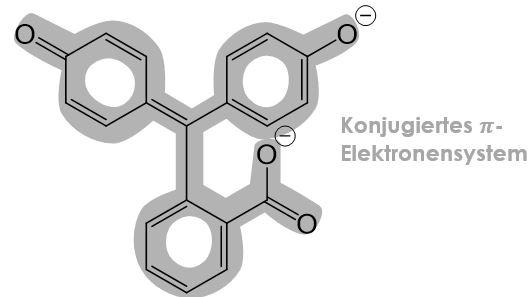
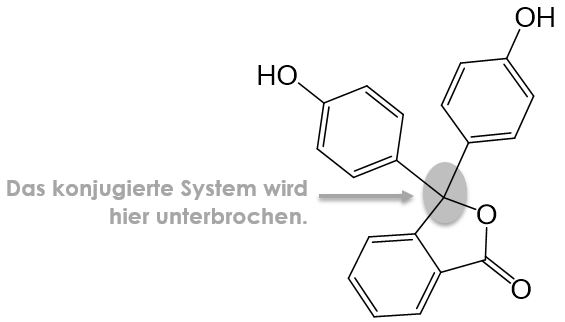
Bei der deprotonierten Form des Phenolphthaleins (rechts) erstreckt sich das konjugierte π-Elektronensystem über das gesamte Molekül, wodurch die pinke Farbe entsteht.
Bei der protonierten Form (links) wird das konjugierte System unterbrochen, wodurch die Größe der einzelnen Konjugierten Systeme nicht ausreicht, um Licht im sichtbaren Bereich zu absorbieren. Daher ist diese Form farblos.
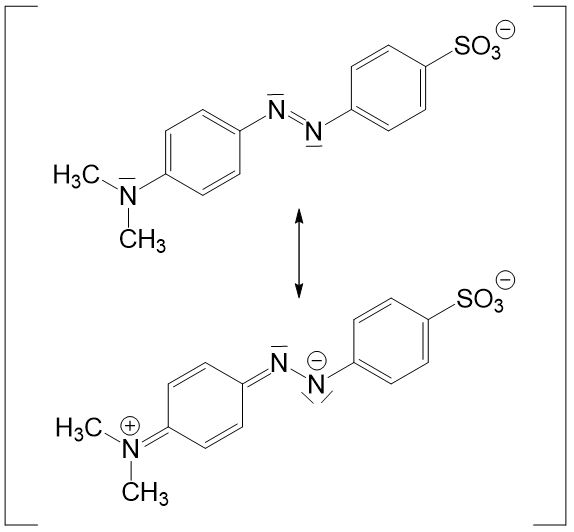
Betrachten wir noch einen anderen Indikator, bei dem die Farbänderung auf eine etwas andere Weise zu erklären ist: Methylorange. Vergleichen wir die deprotonierte mit der protonierten Form, so stellen wir fest, dass die Größe des konjugierten π-Elektronensystems bei beiden Formen gleich groß ist. Dennoch ist die protonierte Form rot und die deprotonierte Form orange.
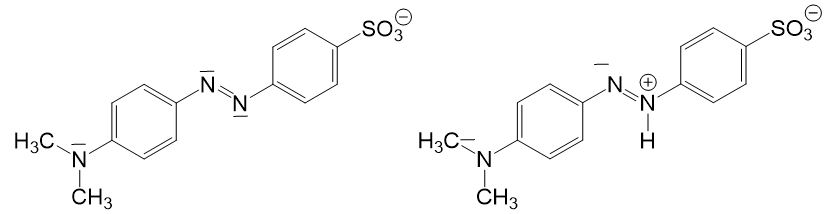
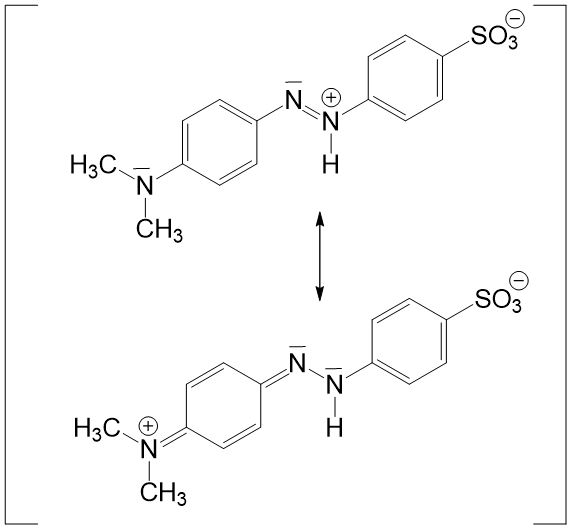
Um die unterschiedliche Farbigkeit zu erklären, müssen wir die Grenzstrukturen der beiden Moleküle betrachten:
Neu!
Bei der Grenzstruktur der protonierten Form wird die positive Ladung innerhalb des Moleküls verschoben. Bei der deprotonierten Form entsteht sowohl eine positive als auch eine negative Ladung, also eine Ladung mehr als bei der protonierten Form.