Alkohole
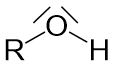
Alkohole sind Kohlenwasserstoffe mit einer funktionellen Gruppe. In einem Alkan werden Wasserstoffatome durch Hydroxygruppen (-OH) ersetzt, weshalb Alkohole im Allgemeinen die folgende Struktur aufweisen:
Viele weitere Grundlagen zu dem Thema Alkohole findest du auf dieser Seite, klicke einfach auf deine gesuchten Themen oder scroll durch die Seite!
Themen auf dieser Seite
Neu!
Einteilung der Alkohole
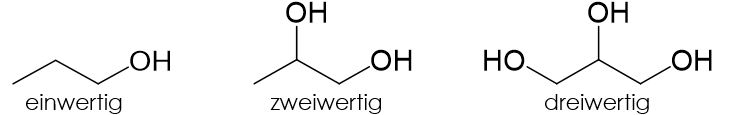
Alkohole können anhand der Anzahl der im Molekül gebundenen Hydroxygruppen eingeteilt werden. Bei Alkoholen mit einer Hydroxygruppe handelt es sich um einen einwertigen Alkohol, bei Alkoholen mit zwei Hydroxygruppen um einen zweiwertigen und bei Alkoholen mit drei Hydroxygruppen um einen dreiwertigen Alkohol. Bei den mehrwertigen Alkoholen ist an ein Kohlenstoffatom meist nur eine Hydroxygruppe gebunden, da sie andernfalls meist instabil sind und unter Wasserabspaltung zerfallen.
-
-
- Alkohole können auch nach der Position der Hydroxygruppe im Molekül eingeteilt werden. Dabei gibt es folgende Möglichkeiten:
- Die Hydroxygruppe ist an ein primäres Kohlenstoffatom gebunden primärer Alkohol
- Die Hydroxygruppe ist an ein sekundäres Kohlenstoffatom gebunden sekundärer Alkohol
- Die Hydroxygruppe ist an ein tertiäres Kohlenstoffatom gebunden tertiärer Alkohol
-
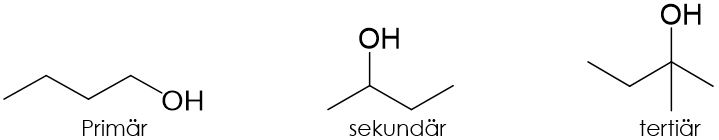
Doch was sind eigentlich primäre, sekundäre und tertiäre Kohlenstoffatome?
Diese Bezeichnungen geben an, wie viele weitere Kohlenstoffatome an einem Kohlenstoffatom gebunden sind. An ein primäres Kohlenstoffatom ist demnach ein weiteres gebunden, an ein sekundäres zwei weitere und an ein tertiäres drei weitere. Im Folgenden sind Beispiele für die verschiedenen, daraus resultierenden Alkohole abgebildet:
Schmelz- und Siedepunkte von Alkoholen
Wie bereits bei den Alkanen beschrieben, hängen der Schmelz- und Siedepunkt von den zwischenmolekularen Wechselwirkungen ab. Hier gelten bezüglich der van-der-Waals-Wechselwirkungen die gleichen Entscheidungsregeln wie bei den Kohlenwasserstoffen. Bei Alkoholen gibt es neben den van-der-Waals-Wechselwirkungen zusätzlich noch Wasserstoffbrückenbindungen zwischen einem freien Elektronenpaaren am Sauerstoffatom der Hydroxygruppe und einem Wasserstoffatom einer anderen Hydroxygruppe. Das freie Elektronenpaar kann allerdings keine Wasserstoffbrückenbindung mit den Wasserstoffatomen, welche an Kohlenstoffatome gebunden sind, ausbilden, da diese aufgrund der geringen Elektronegativitätsdifferenz nicht ausreichend positiv polarisiert sind.
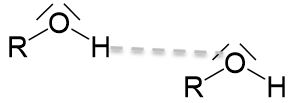
Im Vergleich zu Kohlenwasserstoffen haben Alkohole also höhere Schmelz- und Siedepunkte, da aufgrund der starken Wasserstoffbrückenbindungen die zwischenmolekularen Wechselwirkungen, welche zum Schmelzen oder Sieden überwunden werden müssen, deutlich höher sind.
Werden zwei verschiedene Alkohole miteinander verglichen, so steigen Schmelz- und Siedepunkt mit steigender Anzahl an Hydroxygruppen, da dann mehr Wasserstoffbrückenbindungen ausgebildet werden können.
Löslichkeit von Alkoholen
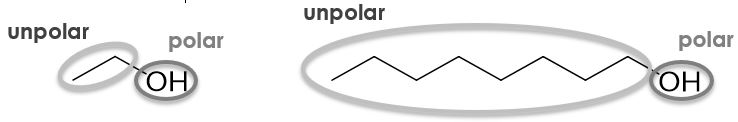
Um eine Aussage über die Löslichkeit von Alkoholen treffen zu können, muss man die Polarität des Moleküls betrachten. Die Hydroxygruppe im Alkohol ist polar, die Kohlenwasserstoffkette ist dahingegen unpolar. Je größer die Kohlenwasserstoffkette also ist, desto größer ist der unpolare Teil des Moleküls und das Molekül löst sich zunehmend besser in unpolaren Lösungsmitteln wie Benzin. Je kürzer die Kohlenwasserstoffkette ist, desto kleiner wird der unpolare Teil des Moleküls und es löst sich zunehmend besser in polaren Lösungsmitteln wie Wasser. Experimentell kann man feststellen, dass sich Alkohole bis Propanol gut in Wasser lösen.
Reaktionsverhalten von Alkoholen
Neu!
Deprotonierung der Hydroxygruppe
Alkohole können wie eine Brönstedt-Säure (Protonendonator) reagieren, die Hydroxygruppe kann also ein Proton abgeben.
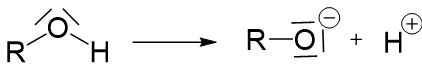
Alkohole sind allerdings sehr schwache Säuren und geben ihr Proton daher nicht besonders gerne ab. Je länger die Kohlenwasserstoffkette eines Alkohols ist, desto schlechter kann das Proton abgegeben werden. Das liegt an dem +I-Effekt der Kohlenwasserstoffkette. Je länger die Kette ist, desto stärker ist der elektronenschiebende +I-Effekt, und desto höher ist die Elektronendichte an der Hydroxygruppe. Dadurch wird das Proton stärker angezogen und schlechter abgegeben.
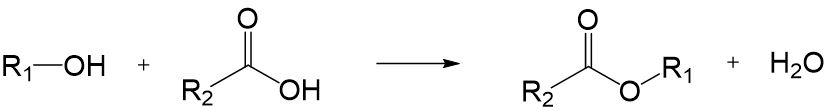
Kondensationsreaktion (nucleophile Substitution)
Alkohole können unter einer sogenannten Kondensationsreaktion mit einer Carbonsäure zu einem Ester reagieren. Dabei entsteht Wasser.
Oxidation
Manche Alkohole können auch unter einer Oxidation mit einem Oxidationsmittel reagieren. Dabei spielt die Position der Hydroxygruppe eine entscheidende Rolle:
Primäre Alkohole lassen sich zu Aldehyden oxidieren.
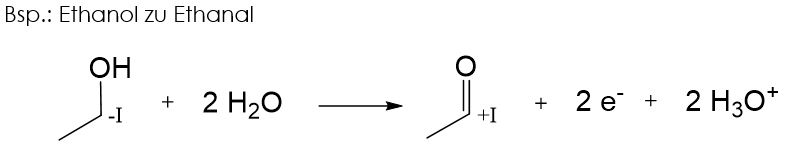
Sekundäre Alkohole lassen sich zu Ketonen oxidieren.
Bsp.: Propan-2-ol zu Propanon
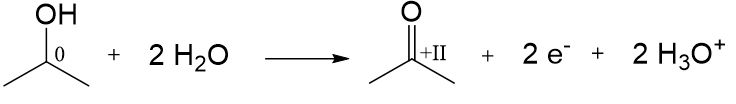
Tertiäre Alkohole lassen sich nicht ohne weiteres oxidieren.
Bsp.: 2-Methylpropan-2-ol
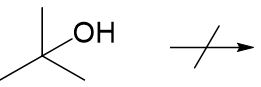
Neu!