Seifen und Tenside
Neu!
Inhalt zu Seifen und Tenside dieser Seite
- Herstellung von Seifen durch Verseifung
- Basische Verseifung
- Saure Verseifung
- Einsatzgebiet von Seifen durch Verseifung
- Herabsetzen der Oberflächenspannung
- Waschwirkung von Seife
- Nachteile von Seifen
- Tenside als Emulgatoren
Tenside sind Moleküle, die sich aus einem polaren Köpfchen und einem unpolaren Rest zusammensetzen. Tenside sind in polaren und unpolaren Lösungsmitteln löslich und werden daher grenzflächenaktive Substanzen genannt.
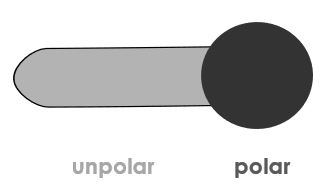
Tenside werden aufgrund ihrer Waschwirkung meist zur Körper- und Oberflächenreinigung verwendet.
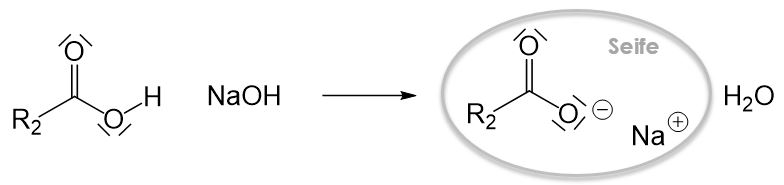
Seifen sind spezielle Tenside. Es handelt sich dabei um Natrium- oder Kaliumsalze von Fettsäuren. Sie weisen die typische Struktur von Tensiden auf: ein unpolarer Rest R und eine Carboxygruppe als polares Köpfchen.
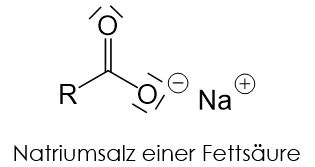
- Seifen, die aus Natriumsalzen einer Fettsäure bestehen sind feste Seifen. Man nennt sie Kernseifen.
- Seifen, die aus Kaliumsalzen einer Fettsäure bestehen sind flüssige Seifen und man nennt sie Schmierseifen.
Herstellung von Seifen durch Verseifung
Seifen werden hergestellt, indem ein Fett in einer Verseifung reagieren lässt. Dabei gibt es zwei Möglichkeiten: die basische und die saure Verseifung.
Im Folgenden sind die beiden Mechanismen dargestellt. Dabei wird die Reaktion nur für eine Estergruppe dargestellt, damit es ein bisschen übersichtlicher ist.
Basische Verseifung
Bei der basischen Verseifung handelt es sich um eine Reaktion, an der eine Base beteiligt ist. Um eine Seife herzustellen wird Natron- (Herstellung einer Kernseife) oder Kalilauge (Herstellung einer Schmierseife) benötigt.
Das freie Elektronenpaar des Hydroxidions der Lauge greift an dem positivierten Kohlenstoffatom des Esters an.
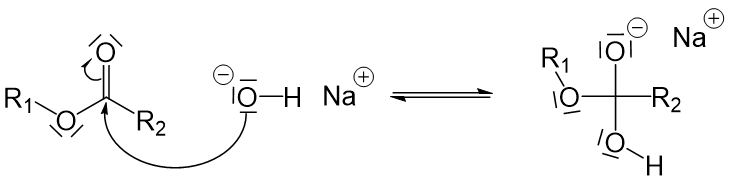
Jetzt sind drei Sauerstoffatome an ein Kohlenstoffatom gebunden, weshalb eine Einfachbindung zwischen dem Kohlenstoffatom und einem Sauerstoffatom aufgebrochen werden muss. Die Einzige, die hier in Frage kommt, ist die Einfachbindung zwischen dem Kohlenstoffatom und dem Sauerstoffatom links vom Kohlenstoffatom in Frage (würden wir die darunter aufbrechen, würden wir wieder am Anfang ankommen, und würden wir die obere aufbrechen, würde ein sehr instabiles O^(2-)-Ion entstehen).
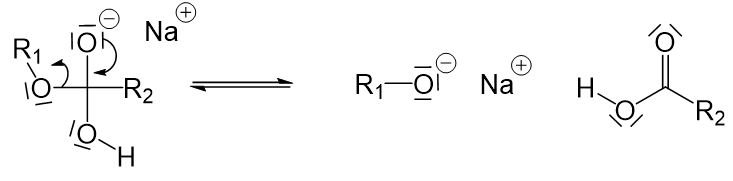
Jetzt ist die Reaktion aber noch nicht fertig. Die Carbonsäure gibt in einem weiteren Reaktionsschritt ihr Proton ab, welches von dem Alkoholation aufgenommen wird.
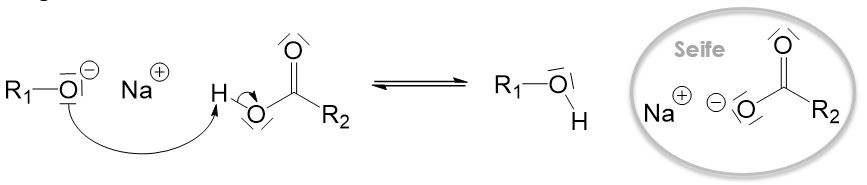
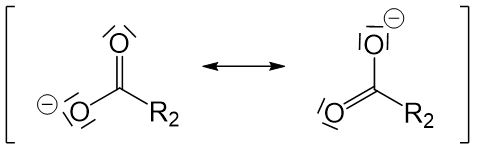
Doch warum bleibt das Proton nicht einfach dort wo es ist? Das liegt daran, dass die negative Ladung, die durch die Deprotonierung entsteht, durch mesomere Grenzstrukturen stabilisiert wird. Beim Alkoholation gibt es keine mesomeren Grenzstrukturen und die negative Ladung daher nicht stabilisiert werden. Daher ist das Alkoholation deutlich instabiler als die deprotonierte Carbonsäure und dieser Reaktionsschritt läuft ab.
Neu!
Saure Verseifung
Bei der sauren Verseifung handelt es sich, wie am Namen erkannt werden kann, um eine Reaktion, an der eine Säure beteiligt ist. Diese Säure wirkt hier als Katalysator. Das freie Elektronenpaar des Carbonyl-Sauerstoffatoms der Estergruppe greift an dem Proton, das von der Säure abgegeben wird, an. Durch den Angriff entsteht eine positive Ladung am Kohlenstoffatom. Dieser Reaktionsschritt ist notwendig, damit die Verseifung ohne Base funktionieren kann.
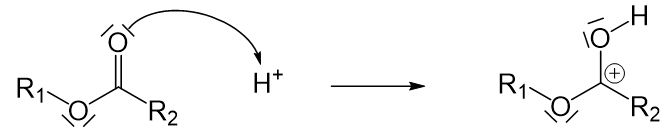
Nun kann das entstandene Kation mit Wasser in einer nucleophilen Substitution reagieren. Hier entsteht wieder ein Molekül, in dem drei Sauerstoffatome an ein Kohlenstoffatom gebunden sind. Es muss eine Einfachbindung aufgebrochen werden. Hier kommt wieder nur die Einfachbindung zwischen dem Kohlenstoffatom und dem Sauerstoffatom links vom Kohlenstoffatom in Frage. Damit diese Einfachbindung leichter aufgebrochen werden kann, findet zunächst eine Umlagerung des Protons vom Sauerstoffatom rechts zum Sauerstoffatom links statt. Durch die so entstehende positive Ladung ist das Sauerstoffatom nicht länger gewillt die Einfachbindung zu teilen. Dies hat zur Folge, dass sie leichter aufgebrochen werden kann.
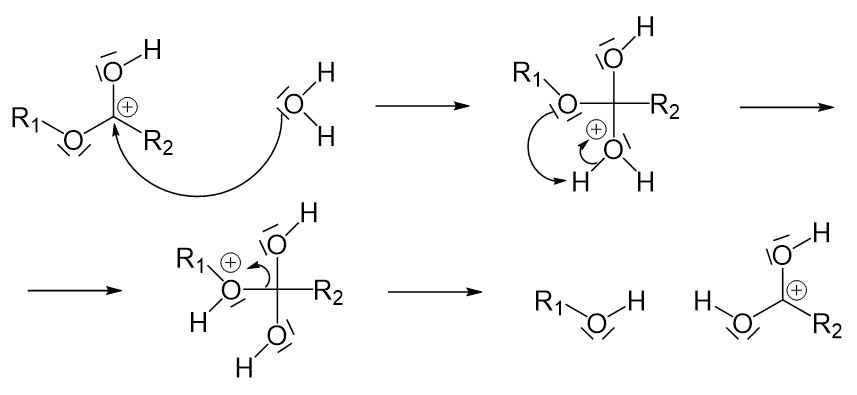
Anschließend muss die positive Ladung am Kohlenstoffatom ausgeglichen werden. Davon abgesehen muss der Katalysator, also das Proton, wiederhergestellt werden, da ein Katalysator unverändert aus der Reaktion hervorgehen muss. So wird das Proton wieder abgespalten und das Elektronenpaar kann wieder „reinklappen“.
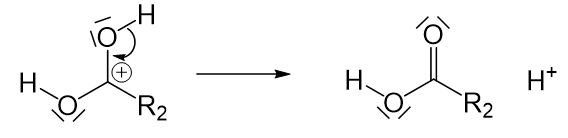
Bei dem Reaktionsprodukt handelt es sich um eine Fettsäure. Um eine Seife zu erhalten benötigen wir aber ein Natrium- oder Kaliumsalz einer Fettsäure. Um eine Seife herzustellen müssen wir die entstandene Fettsäure noch mit Natron- oder Kalilauge zur Reaktion bringen.
Einsatzgebiet von Seifen durch Verseifung
Herabsetzen der Oberflächenspannung
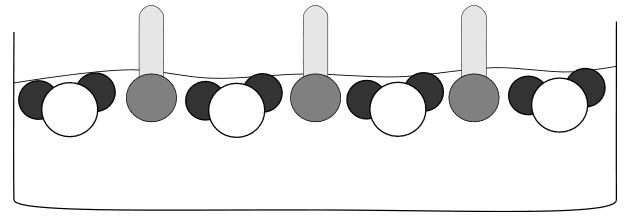
Wasser hat eine starke Oberflächenspannung. Das liegt an den zwischenmolekularen Wasserstoffbrückenbindungen. Die Wassermoleküle ziehen sich durch diese Wechselwirkungen gegenseitig an. An der Wasseroberfläche bedeutet das, dass die Wassermoleküle nach innen gezogen werden. Dadurch entsteht die Oberflächenspannung.
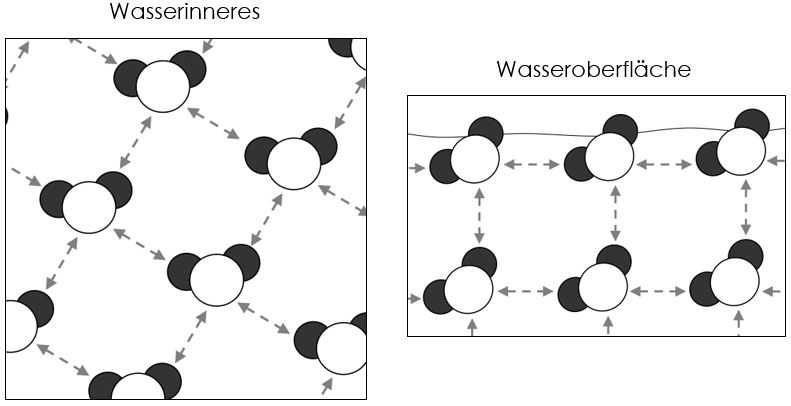
Durch die Zugabe von Tensiden in Wasser werden die zwischenmolekularen Kräfte des Wassers erniedrigt, da sich die Tenside zwischen den Wassermolekülen anlagern. Dies führt zu einer Erniedrigung der Oberflächenspannung des Wassers.
Neu!
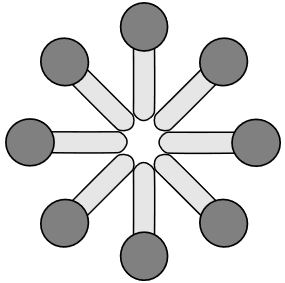
Bildung von Mizellen
Obwohl Tenside einen langkettigen, unpolaren Rest haben, lassen sie sich in Wasser lösen. Das liegt daran, dass sie sogenannte Mizellen bilden. Das sind kugelförmige Gebilde, die entstehen, indem sich die unpolaren Reste gegenseitig anziehen, da zwischen ihnen zwischenmolekulare Wechselwirkungen wirken. Die polaren Köpfchen der Tenside bilden eine äußere Schale. Durch diese Mizellenbildung können sich Tenside nicht nur an der Wasseroberfläche anlagern, sondern lösen sich auch im Wasser.
Waschwirkung von Seife
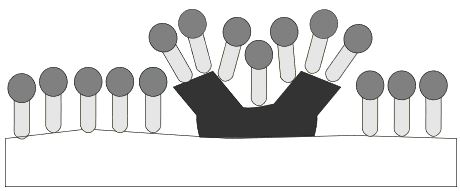
Lagert sich unpolarer Schmutz an einer Faser an, so kann dieser mit Wasser nicht entfernt werden, da er sich nicht in Wasser löst. Mit Hilfe von Tensiden kann der Schmutz von der Faser gelöst werden. Dabei laufen folgende Prozesse ab:
Die Faser- und Schmutz-oberflächen werden mit Tensiden benetzt. Die unpolaren Reste der Tenside wechselwirken mit den unpolaren Oberflächen, wodurch die Benetzung entsteht.
Da die Tenside nicht linear nebeneinander angeordnet sind, kommen die geladenen Carboxy-gruppen miteinander in Berührung. Diese stoßen sich gegenseitig ab, wodurch der Schmutz auseinander-gebrochen wird. Dadurch entsteht mehr Platz für erneute Tensid-anlagerungen.
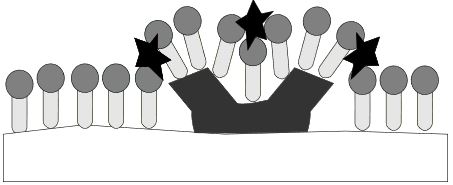
Wie zuvor auch stoßen sich die geladenen Carboxygruppen gegenseitig ab. Der Schmutz wird dadurch nach und nach von der Textilfaser abgetrennt.
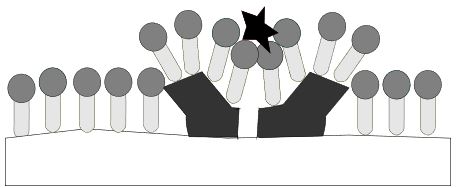
Nachdem der Schmutz vollständig von der Textilfaser getrennt wurde, entstehen sogenannte Schmutz-Tensid-Mizellen, das heißt der Schmutz ist vollständig von Tensiden umgeben. An der Textilfaser lagern sich auf der gesamten Oberfläche Tenside an, was bewirkt, dass der Schmutz sich nicht mehr an der Faser anlagern kann. Der Schmutz ist also dauerhaft entfernt.
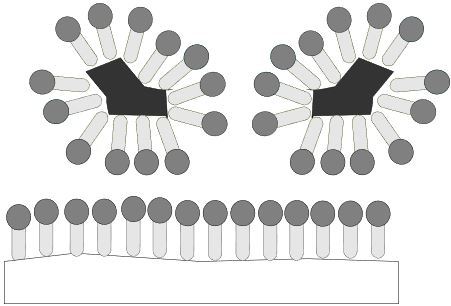
Nachteile von Seifen
Seifen haben einige Nachteile, weshalb wir heutzutage zum Waschen synthetische Tenside verwenden.
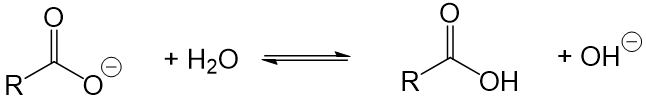
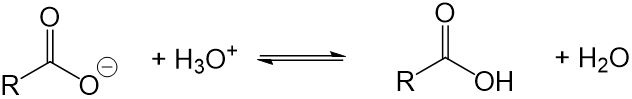
- Seifenmoleküle bilden in Wasser Hydroxidionen, das heißt es entsteht eine alkalische Lösung. Diese greift die Haut, Textilfasern und Waschmaschinenbauteile an und beschädigt diese auf Dauer. Außerdem entsteht bei dieser Reaktion ein Fettsäuremolekül, welches keine Waschwirkung mehr aufweist. Die Waschwirkung wird also ebenfalls reduziert.
- Seifen sind säureempfindlich. Wird der Seifenlösung in irgendeiner Form eine Säure zugefügt (z.B. weil du mit einem Tuch Essig aufgewischt hast und dieses nun wäschst), wird die Waschwirkung reduziert, da die Seifenmoleküle mit der Säure reagieren. Dabei entsteht ein Fettsäuremolekül, welches keine Waschwirkung aufweist.
- Seifen sind härteempfindlich. Die Waschwirkung wird bei der Verwendung von hartem Wasser erheblich reduziert, da die Seifenmoleküle mit den vorhandenen Calciumionen reagieren und schwerlösliche Salze bilden, welche keine Waschwirkung mehr aufweisen. Diese Salze lagern sich dann außerdem an der Kleidung an.
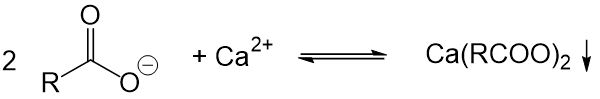
Aufgrund dieser Nachteile, wurden synthetische Tenside entwickelt, welche diese Nachteile nicht aufweisen. Die häufigsten Vertreter der synthetischen Tenside sind die sogenannten Alkylbenzolsulfonate. Sie haben folgende Struktur (wobei n eine Zahl zwischen 8 und 16 ist):
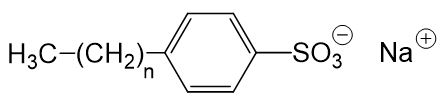
Alkylbenzolsulfonate reagieren in wässriger Lösung neutral, sind nicht säureempfindlich und sind nur wenig empfindlich gegenüber hartem Wasser.
Neu!
Tenside werden nicht nur als Waschsubstanzen eingesetzt, sondern auch als Emulgatoren. Dabei werden unpolare Teilchen von den unpolaren Resten der Tenside umschlossen, wodurch kugelförmige Gebilde mit einer polaren Schale entstehen, wie bei den Mizellen. Durch die polare Schicht kann dieses Gebilde dann mit dem polaren Stoff wechselwirken und es wird darin gelöst.