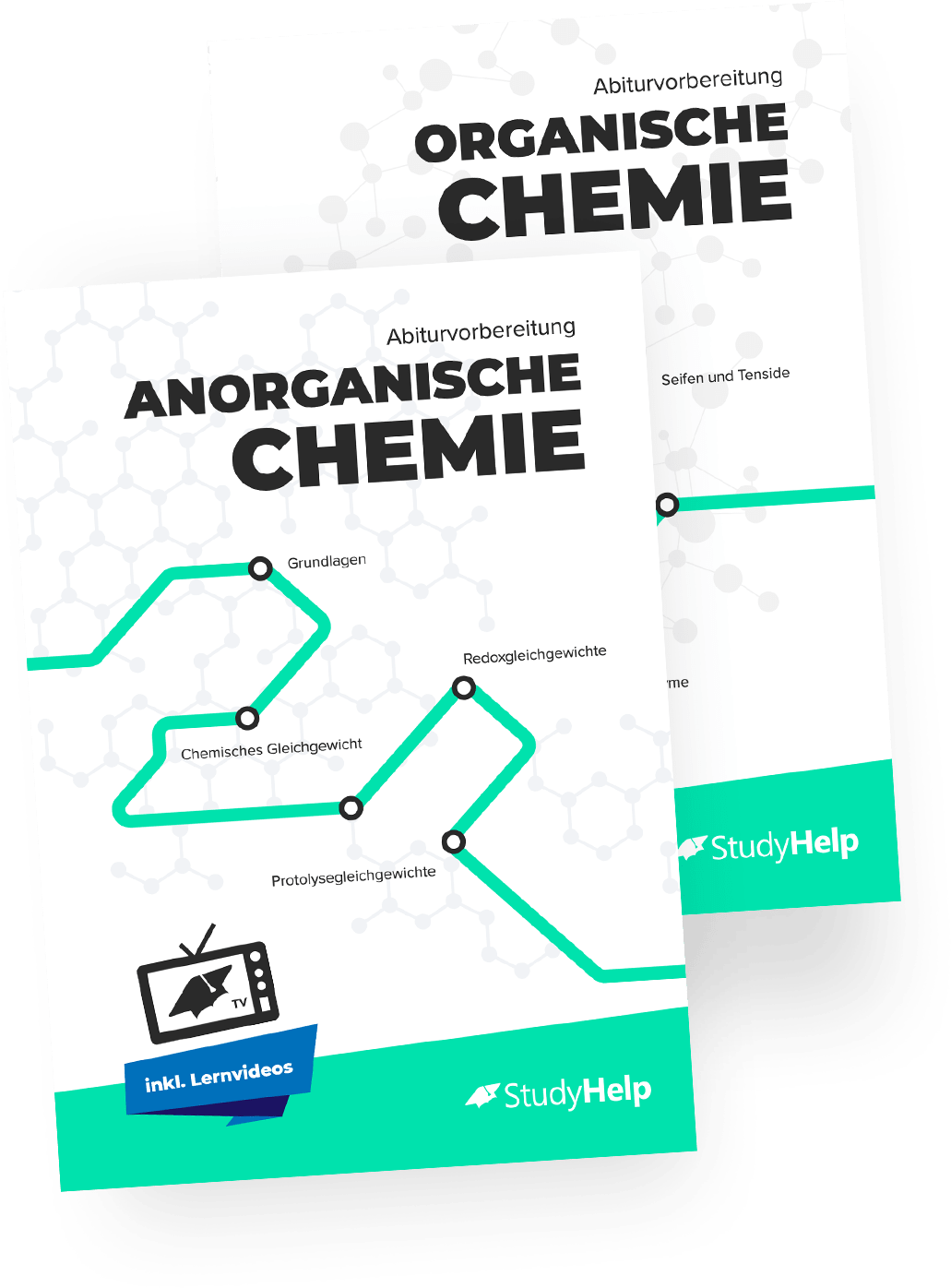
Azofarbstoffe
Azofarbstoffe werden in der Industrie dafür verwendet viele verschiedene Materialien, wie z.B. Textilien oder auch Lebensmittel, zu färben. Mit ihren über mehrere Tausend verschiedenen Farben sind sie für diesen Gebrauch besonders gut geeignet. Seit dem Jahr 2010 müssen die Farbstoffe mit dem Buchstaben „E“ gekennzeichnet werden.
Neu!
Aus Sicht der Chemie weisen Azofarbstoffe ein bestimmtes Sutrukturmerkmal auf: Sie bestehen aus einer sogenannten Azogruppe. Dies ist eine Verbindung, die Stickstoff-Atome enthält, die durch eine Doppelbindung miteinander verbunden sind – Sie wird auch aromatische Verbindung genannt.
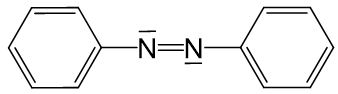
Azofarbstoffe sind farbig, da sie ein ausgedehntes delokalisiertes π-Elektronensystem besitzen und somit Licht aus dem sichtbaren Bereich absorbieren.
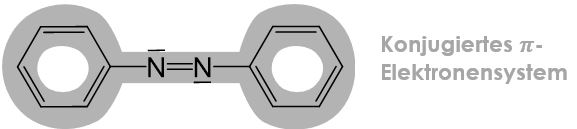
Da Azofarbstoffe ein delokalisiertes π-Elektronensystem besitzen gibt es auch hier mesomere Grenzstrukturen:
Neu!
Herstellung von Azofarbstoffe
Die Herstellung von Azofarbstoffen erfolgt nach einem bestimmten Mechanismus, der in zwei Schritten abläuft. Als Erstes erfolgt die sogenannte Diazotierung. Als Zweites erfolgt die Azokupplung.
Für die Diazotierung wird ein Nitrosylkation NO^+ benötigt. Dieses Ion entsteht unter folgender Reaktion zwischen salpetriger Säure und einem Oxoniumion:
![]()
Das Nitrosylkation kann jetzt mit Anilin unter einer elektrophilen Substitution reagieren, indem das freie Elektronenpaar des Stickstoffatoms im Anilinmoleküls an der positiven Ladung des Nitrosylkations angreift.
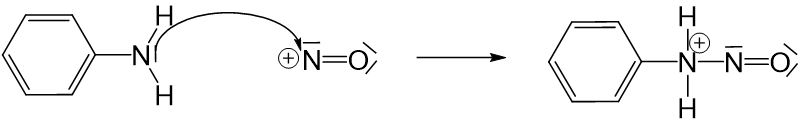
Durch diesen Reaktionsschritt entsteht eine positive Ladung am Stickstoffatom, welche nun ausgeglichen werden muss. Dieser Ausgleich gelingt nur, wenn eine Einfachbindung nicht mehr geteilt werden muss. Aus diesem Grund wird ein Proton abgegeben. Jetzt stellt sich die Frage, wo dieses Proton hinwandert. Hierzu gibt es zwei Möglichkeiten: das freie Elektronenpaar des Stickstoffatoms-, oder das freie Elektronenpaar des Sauerstoffatoms nimmt das Proton auf. In unserem Fall wird das Proton am Sauerstoffatom aufgenommen, da noch ein zweites Proton zur Verfügung steht. Dieses Proton hat die Möglichkeit zu wandern, was zur Folge hat, dass Wasser abgespalten werden kann (hier gilt wieder das Prinzip: wenn durch intramolekulare Protonenwanderung Wasser abgespalten werden kann, ohne, dass dadurch Probleme entstehen, wird die Abspaltung eintreten!)
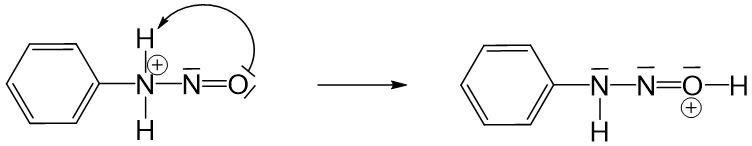
Um das zweite Proton am Sauerstoffatom zu binden wird die Doppelbindung verwendet.
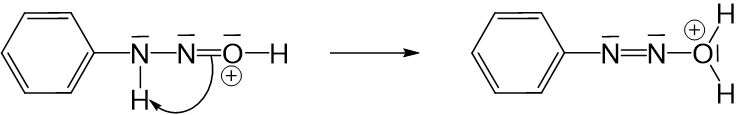
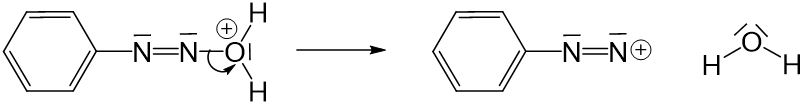
Wenn nun die Einfachbindung zwischen dem Stickstoffatom und dem Sauerstoffatom getrennt wird, wird auch Wasser abgespalten. Dabei entsteht eine positive Ladung am Stickstoffatom. Bei dem entstandenen Molekül handelt es sich um ein sogenanntes Diazoniumion, wodurch die Diazotierung abgeschlossen ist.
Neu!
Im nächsten Schritt folgt die Azokupplung. Dabei reagiert das Diazoniumion mit einem weiteren Anilinmolekül in einer elektrophilen aromatischen Substitution. Ein Elektronenpaar aus einer Doppelbindung des Aromaten greift an der positiven Ladung des Diazoniumions an. Hier solltest du dir immer überlegen, an welcher Position das Diazoniumion gebunden wird. Dazu müssen wir den Effekt der Aminogruppe des Anilins betrachten. Diese Gruppe hat einen +M-Effekt und ist daher ortho- und paradirigierend. Aus Platzgründen binden wir das Diazoniumion nun an der Position para:
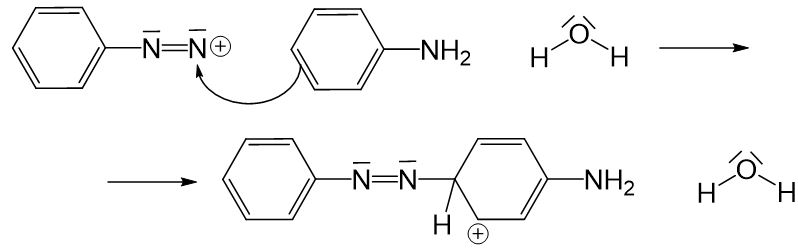
Durch diesen Reaktionsschritt entsteht eine positive Ladung an einem Kohlenstoffatom im Ring und das aromatische System besteht nicht mehr. Die positive Ladung muss ausgeglichen und das aromatische System wiederhergestellt werden. Das ist nur möglich, indem das Proton an der Stelle, an der das Diazoniumion gebunden wurde, abgespalten wird und das Elektronenpaar der Einfachbindung in den Ring geklappt wird. Das Proton kann von dem vorhandenen Wassermolekül aufgenommen werden, wodurch ein Oxoniumion entsteht.
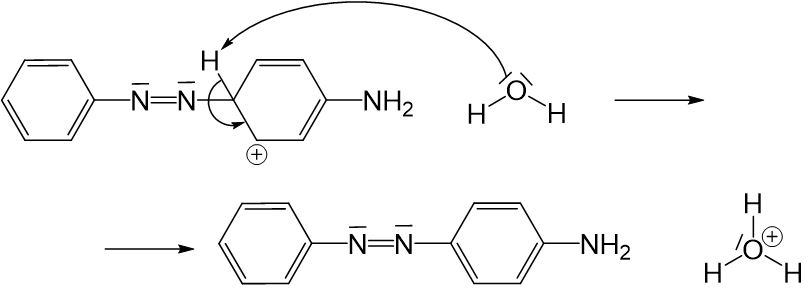
Das aromatische System ist wiederhergestellt und es existiert keine problematische positive Ladung mehr in dem Molekül. Die Reaktion ist also abgeschlossen und es wurde ein Azofarbstoff hergestellt.
Neu!